1、填空题 (12分)食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 (填选项字母)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
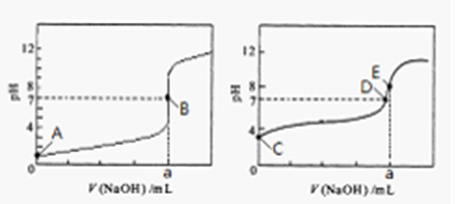
图3 图4
①滴定醋酸溶液的曲线是 (填“图l”或“图2”);滴定曲线中a= mL
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸图2
(5)酸式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴定结果(填“偏小”、“偏大”或“无影响”) ;酸式滴定管读数时,若先俯后仰,则结果会 。
参考答案:(1)bd (2)c (3)①图2 20.00mL (4)d (5)偏大 偏大
本题解析:(1)醋酸是弱酸,离子方程式中用化学式表示,a不正确。浓度过大,反应过快,不利于判断滴定终点,所以可以通过稀释来降低反应速率,b正确。醋酸和氢氧化钠反应,终点时溶液显碱性,因此选择酚酞作指示剂,不用甲基橙。物质的量浓度为0.75mol·L-1,则该食醋的总酸量为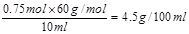 ,d正确。
,d正确。
(2)根据较强酸制取较弱的原理可判断,可通过比较二者的电离常数来比较其酸性强弱。
(3)盐酸和氢氧化钠恰好反应时溶液显中性,而醋酸和氢氧化钠恰好反应时溶液显碱性,所以图2表示醋酸的滴定曲线。
(4)电离度是指在来源:91考试网 91ExAm.org一定温度下,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。因此要测定醋酸的电离度,需要测定醋酸的物质的量浓度以及已电离的醋酸的物质的量浓度。根据电离方程式可知,可通过测定溶液的pH值来测定已电离的醋酸的物质的量浓度。
(5)酸式滴定管用蒸馏水润洗后,未用标准液润洗,则标准液被稀释,结果偏大。若先俯后仰,则消耗的体积偏大,结果会偏大。
本题难度:困难
2、填空题 (6分)下列10种物质中:①NaOH溶液②H2SO4③硫酸铜晶体④Cu ⑤CH3COOH?⑥NaOH固体⑦蔗糖⑧石灰水⑨水银⑩氨水
能导电的有?;属于强电解质的有?;属于弱电解质的有?。
参考答案: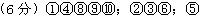
本题解析:略
本题难度:简单
3、选择题 100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示。下列说法正确的(?)
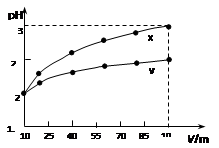
A.x为弱酸,y为强酸
B.稀释前x、y的物质的量浓度相等
C.随着稀释的进行,y的电离程度减小
D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多
参考答案:D
本题解析:从图上分析,X,Y两种一元酸体积都扩大了10倍,如果两者都是强酸,那么PH值根据稀释原理和PH值计算会从2升高到3,但实际的结果是X升高到3,Y并没有升高那么多,这说明X是强酸,Y是弱酸,只有弱酸中存在电离平衡,在稀释的时候,会电离出H+来削弱PH值升高这种趋势。
由上述理由可推知:A错误,X为强酸,Y为弱酸。
B错误,Y这种弱酸只能部分电离,要使得Y的PH值与X相同,那么Y的浓度必须大于X。
C错误,稀释使电离平衡正向移动,Y的电离程度应该增大。
D正确,因为Y的浓度大于X,在等体积的情况下,Y的物质的量也是大于X的,能产生的氢气在金属足量的情况下要多于X。
本题难度:一般
4、选择题 在0.1mol?L-1 NH3?H2O溶液中存在如下电离平衡:NH3?H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
A.降低温度,溶液中c(NH4+)增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1mol?L-1 HCl溶液,溶液中c(OH-)增大
D.加入水时,溶液中
增大
参考答案:A.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中铵根离子浓度减小,故A错误;
B.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故B错误;
C.向氨水中加入少量浓盐酸,氢离子和氢氧根离子反应生成水,所以氢氧根离子浓度减小,故C错误;
D.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中氢氧根离子浓度与一水合氨分子浓度之比增大,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列电离方程式错误的是
A.NaHCO3 = Na++HCO3-
B.NaHSO4 = Na++H++SO42-
C. H2CO3 =2H++CO32-
H2CO3 =2H++CO32-
D.KCl O3= K++ClO3-
O3= K++ClO3-
参考答案:C
本题解析:略
本题难度:简单