1、选择题 与纯水的电离相似,液氨中存在着微弱的电离:2NH3?NH2-+NH4+据此判断,下列叙述中不正确的是( )
A.液氨中含有?NH3、NH4+、NH2-?等粒子
B.一定温度下,液氨中?c?(NH4+?)与?c?(NH2-?)的乘积为定值
C.液氨的电离达到平衡时,c?(NH3?)=c?(NH4+?)=c?(NH2-?)
D.只要不加入其他物质,液氨中c?(NH4+?)=c?(NH2-?)
参考答案:A.液氨电离中存在电离平衡,所以液氨中含有?NH3、NH4+、NH2-?等粒子,故A正确;
B.液氨中?c?(NH4+?)与?c?(NH2-?)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中?c?(NH4+?)与?c?(NH2-?)的乘积为定值,故B正确;
C.液氨的电离是微弱的,所以液氨电离达到平衡状态时,c?(NH4+?)=c?(NH2-?)<c?(NH3?),故C错误;
D.只要不破坏氨分子的电离平衡,液氨电离出的NH4+?和NH2-?的物质的量就相等,因为溶液的体积相等,所以c?(NH4+?)=c?(NH2-?),故D正确;
故选C.
本题解析:
本题难度:简单
2、选择题 下列实验过程中产生的现象与对应的图形正确的是( )
A.NaAlO2溶液中加入盐酸
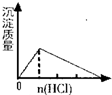
B.SO2气体通入溴水中

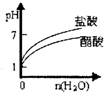
C.pH=2的醋酸与盐酸溶液分别加水稀释
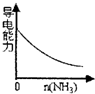
D.氨气通入醋酸溶液中
参考答案:A.在NaAlO2溶液中加入盐酸,发生反应分别为AlO2-+H++H2O═Al(OH)3↓,Al(OH)3↓+3H+═Al3++3H2O,反应开始时有沉淀生成,然后沉淀溶解,故A正确;
B.SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,但溴水溶液呈酸性,开始时pH<7,故B错误;
C.醋酸为弱酸,加水稀释时进一步电离,pH变化较盐酸小,但无论怎么稀释,溶液都成酸性,不可能呈碱性,故C错误;
D.氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25 ℃)
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7
K2=5.6×10-11
|
?
则下列有关说法正确的是( )
A.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
B.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
D.在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
参考答案:D
本题解析:A项中由c(Na+)>c(CN-),据溶液中电荷守恒知c(H+)<c(OH-),所以a可能等于或小于b,A项错;冰醋酸中逐滴加水,溶液的导电性先增大后减小,电离度增大,pH先减小后增大,B项错;C项中没有说明各溶液的物质的量浓度,故无法比较,C项错;由质子守恒得:c(OH-)=c(CH3COOH)+c(H+),D项正确。
本题难度:一般
4、选择题 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是
A.c(OH-)
B.pH
C.c(NH4+)/c(NH3·H2O)
D.c(H+)·c(OH-)
参考答案:C
本题解析:在氨水溶液中加水稀释,促进NH3·H2O的电离:NH3·H2O NH4++OH-,c(OH-)减小,pH减小,而Kw=c(H+)·c(OH-)不变;但c(NH4+)/c(NH3·H2O)=n(NH4+)/n(NH3·H2O)增大;故选C。
NH4++OH-,c(OH-)减小,pH减小,而Kw=c(H+)·c(OH-)不变;但c(NH4+)/c(NH3·H2O)=n(NH4+)/n(NH3·H2O)增大;故选C。
本题难度:一般
5、填空题 已知25℃时部分弱电解质的电离平衡常数数据如下表:
化学式
| CH3COOH
| H2CO3
| HClO
|
平衡常数
| Ka=1.8×10-5
| Ka1=4.3×10-7
| Ka2=5.6×10-11
| Ka=3.0×10-8
|
| | | |
|
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH? b.Na2CO3? c.NaClO d.NaHCO3;? PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
A.c(H+)
B.c(H+)/ c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/ c(H+)
