1、计算题 将镁粉和碳酸镁的混合物置于氧气中灼烧,直至质量不再改变为止。经测定,灼烧后所得固体质量与原混合物质量相同,求原混合物中镁粉和碳酸镁的质量比。
参考答案:11∶14
本题解析:整个题目全用文字叙述,没有一个可供直接利用的具体数据。仔细审视题意,抓住关键词语,将“灼烧后所得固体质量与原混合物质量相同”转化为(化隐含为显露)“Mg吸收的O2质量等于MgCO3分解放出的CO2质量”,即可由2Mg→O2和MgCO3→CO2,导出44Mg→16MgCO3。这一关系式表明,在原混合物中镁粉与碳酸镁的质量比是44×24∶16×84=11∶14。
本题难度:简单
2、选择题 下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是
[? ]
A.AlCl3和NaOH
B.Na2CO3和HCl
C.Ca(HCO3)2和KOH
D.NaCl和AgNO3
参考答案:CD
本题解析:
本题难度:简单
3、选择题 既能和盐酸反应又能和NaOH溶液反应的氧化物是
A.Al(OH)3
B.Na2CO3
C.Al2O3
D.CO2
参考答案:C
本题解析:Al2O3+6HCl=2AlCl3+3H2O? Al2O3+2NaOH+3H2O=2Na[Al(OH)4],故选C;
Al(OH)3是既能和盐酸反应又能和NaOH溶液反应的氢氧化物;
Na2CO3是只能和盐酸反应的盐;
CO2是只能和NaOH溶液反应的氧化物;
本题难度:一般
4、实验题 (15分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2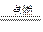 2MgO;②3Mg+N2
2MgO;②3Mg+N2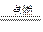 Mg3N2;
Mg3N2;
③2Mg+CO2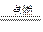 2MgO+C?④Mg+H2O
2MgO+C?④Mg+H2O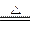 MgO+H2↑?⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑?⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
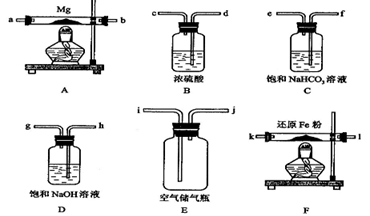
回答下列问题;
(1)?在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
?(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)______? ?;
?;
(3)通气后,应先点燃?处的酒精灯,再点燃?处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?________?__;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:_____________。
参考答案:

本题解析:略
本题难度:一般
5、选择题 下列叙述正确的是
A.Fe与S混合加热生成FeS2
B.NaHCO3的热稳定性大于Na2CO3
C.过量的铜与浓硝酸反应有一氧化氮生成
D.在常温下,铝与浓硫酸不会发生反应
参考答案:C
本题解析:分析:A.铁与硫反应生成低价态的铁;
B.碳酸氢钠受热易分解;
C.铜和浓硝酸反应生成二氧化氮;
D.铝和浓硝酸发生钝化反应;
解答:A.铁和硫在加热的条件下反应生成硫化亚铁,不是生成二硫化亚铁,故A错误;
B.碳酸氢钠在加热的条件下分解生成碳酸钠和水和二氧化碳,而碳酸钠受热不分解,所以碳酸钠的热稳定性比碳酸氢钠强,故B错误;
C.铜和浓硝酸反应生成硝酸铜和二氧化氮和水,但随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮和水,故C正确;
D.在常温下,铝和浓硝酸发生钝化反应,是在金属的表面生成致密的氧化膜,该反应是化学变化,故D错误;
故选C.
点评:本题考查了元素化合物的性质,掌握常见的金属的化学性质是解答本题的关键,题目较简单.
本题难度:困难