1、选择题 镁和铝都是较活泼金属,下列叙述不正确的是
①镁易溶于冷水,而铝难溶于冷水②镁溶于碱液,而铝难溶于碱液③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
A.①
B.②
C.③
D.全部
参考答案:D
本题解析:镁不易溶于冷水,可和沸水反应生成氢氧化镁和氢气,镁不溶于碱液,而铝易溶于碱液生成偏铝酸盐和氢气,常温下镁易溶于浓硫酸,而铝于浓硫酸纯化不易溶解。
本题难度:一般
2、选择题 关于金属的下列说法,正确的是(?)
A.常温下,金属都是银白色固体
B.金属都有良好的延展性,都可抽成细丝或压成薄片
C.钠的熔点比钾的高,密度也比钾的大
D.铜和铝常被用作导线的原因是其导电性质良好
参考答案:CD
本题解析:A选项错,一是金属都为银白色不对,如金为金黄色;二是常温下都为固体不对,如汞常温下为液体;B选项错,并不是所有金属都有良好的延展性,有些金属延展性很差,如锑、铋、锰等,受到敲打时易碎成小块;C、D选项都正确。
本题难度:简单
3、填空题 (10分)混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化,据此回答有关问题:
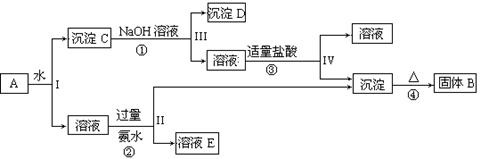
(1)I、II、III、IV中溶液和沉淀分离采取的实验操作需要用到的玻璃仪器是?、 ?、 ?。 固体B的化学式为?。
(2)按要求写出上述过程①、②、③中发生的主要反应的离子方程式
①?。
②?。
③?。
参考答案:(10分)
(1)玻璃棒、烧杯、漏斗。Al2O3(每空1分)
(2)(每空2分)
①Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2[Al(OH)4]-
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③AlO2-+H++H2O=Al(OH) 3↓或[Al(OH)4]-+H+= H2O+Al(OH) 3↓
本题解析:(1)I、II、III、IV操作都是过滤操作,需要的玻璃仪器有玻璃棒、烧杯、漏斗;沉淀C是氧化铝、氧化铁的混合物,加氢氧化钠溶液后沉淀D是氧化铁,所以得到的溶液是偏铝酸钠溶液,加入适量盐酸可以生成氢氧化铝沉淀,氢氧化铝受热分解得氧化铝,所以固体B的化学式为Al2O3;
(2)①为氧化铝与氢氧化钠溶液的反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O;②为硫酸铝钾中的铝离子与氨水反应生成氢氧化铝沉淀,Al3++3NH3·H2O=Al(OH) 3↓+3NH4+;③为偏铝酸根离子与氢离子反应生成氢氧化铝沉淀,离子方程式是AlO2-+H++H2O=Al(OH) 3↓。
本题难度:一般
4、简答题 材料在人类生活、生产中发挥着重要的作用.
(1)钠、铝、铁是常见的金属.
①在三种金属元素中,所形成氧化物种类最多的是______;三种元素形成的氧化物中属于碱性氧化物的有______种.
②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为______,
得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为______.
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为______,可能存在的阳离子为______,一定不存在的阳离子为______.
④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为______,要得到1mol金属铁,需要铝的质量______g.
(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳.若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为______.
参考答案:(1)①钠元素有氧化钠、过氧化钠,铝元素只有氧化铝,铁元素有氧化亚铁、氧化铁、四氧化三铁等,Fe元素所形成氧化物种类最多;氧化钠、氧化亚铁、氧化铁属于碱性氧化物,故答案为:铁;3;
②硫酸铝与氨水反应生成硫酸铝与氢氧化铝沉淀,反应离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
氢氧化铝具有弱碱性,与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,可以治疗胃酸过多,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;Al(OH)3+3H+=Al3++3H2O;
③把金属铁加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,发生2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,剩余固体中有铜无铁,则与Cu反应的离子一定不存在,Fe3+完全反应,一定没有,溶液中一定含有阳离子为Fe2+,可能含有Cu2+完全反应,
故答案为:Fe2+;Cu2+;Fe3+;
④铝与氧化铁发生反应生成Fe与氧化铝,反应方程式为2Al+Fe2O3高温.Al2O3+2Fe,根据方程式可知生成1molFe需要Al的物质的量为1mol,需要Al的质量=1mol×27g/mol=27g,
故答案为:2Al+Fe2O3高温.Al2O3+2Fe;27;
(2)60g二氧化硅的物质的量=30g60g/mol=0.5mol,根据电子转移守恒可知n(CO)=0.5mol×42=1mol,故生成CO的体积=1mol×22.4L/mol=22.4L,
故答案为:22.4L.
本题解析:
本题难度:一般
5、选择题
|
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为

[? ]
A.6:1
B.3:1
C.2:1
D.1:2
参考答案:D
本题解析:
本题难度:一般