1、选择题 当不慎有大量Cl2逸出污染周围空气时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该物质适宜采用的是( )
A.NaOH
B.NaCl
C.HCl
D.Na2CO3
参考答案:A、NaOH虽能与氯气反应,达到吸收氯气的效果,但NaOH的腐蚀性强,不能用浸有浓NaOH溶液的毛巾捂住鼻子,故A错误;
B、NaCl不与氯气反应,且NaCl溶液抑制氯气的溶解,则不能用浸有NaCl溶液的毛巾捂住鼻子来防止吸入氯气中毒,故B错误;
C、盐酸是酸性物质,和氯气不会发生反应,不能吸收氯气,故C错误;
D、Na2CO3溶液显碱性,能与氯气反应而防止吸入氯气中毒,则可以用浸有Na2CO3溶液的毛巾捂住鼻子,故D正确.
故选:D.
本题解析:
本题难度:简单
2、简答题 (1)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去.产生该现象的原因可能有两个:
①是由于______;②是由于______.?
用实验证明红色褪去的原因是①或者是②,其方法是:____________.
(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl,当消耗6.72L标准状况下的氯气时,生成0.10mol氮的氯化物,则此氮的氯化物的化学式为______.
参考答案:(1)因酚酞遇碱变红,将新制氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,则可能为氯水中的酸性与碱反应,使NaOH减少,而能使溶液由红色变成无色;
也可能为氯水中的次氯酸有漂白性,使溶液由红色变成无色.
因次氯酸漂白后的溶液再加NaOH溶液不会恢复颜色,向褪色溶液中再滴加NaOH溶液,若红色再现,则是①;若红色不再现,则是②.
故答案为:氯水中H+与碱中和;氯水中HClO强氧化性所致;向褪色溶液中再滴加NaOH溶液,若红色再现,则是①;若红色不再现,则是②;
(2)xCl2+yNH4Cl→yNCln+(x+y)HCl,根据氧化还原反应中得失电子数相等配平该方程式,
(n+3)Cl2+2NH4Cl=2NCln+8HCl
? n+3?2?
?6.72L22.4L/mol 0.10mol
所以n=3,该氯化物的化学式为NCl3.
故答案为:NCl3.
本题解析:
本题难度:一般
3、计算题 称取NaI和NaCl的混合物10克加水溶解,再通入足量的氯气,然后将溶液蒸发至干,强热后得固体6.65克,求混合物中NaI的质量分数。
(相对原子质量? Na: 23、Cl:35.5、I:127)
参考答案:54.9%
本题解析:设混合物中碘化钠的物质的量是x,则
Cl2?+ 2NaI=I2+2NaCl
1mol? 2mol? 2mol
x? x
由于单质碘以升华,所以强热后得固体6.65g全部是氯化钠,则
58.5g/mol·x+10g-150g/mol·x=6.65g
解得x=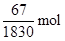
所以混合物中NaI的质量分数是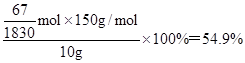
点评:该题是基础性试题的考查,难度不大,主要是有利于培养学生的逻辑推理能力和规范答题能力。该题的关键是明确反应的原理,然后根据方程式直接列式计算即可。另外该题也可以采用差量法解答。
本题难度:一般
4、选择题 下列有关氯气的叙述中,正确的是(?)
A.工业上常用MnO 2和稀盐酸共热来制取氯气
2和稀盐酸共热来制取氯气
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.在氧化还原反应中,Cl2只能作氧化剂
D.若含0.4 mol HCl的浓盐酸,MnO2过量,可制得标准状况下氯气2.24 L
参考答案:B
本题解析:略
本题难度:简单
5、实验题 实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题:

(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶 91exam.org液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
参考答案:(1)分液漏斗 圆底烧瓶? (2)饱和食盐水 除去氯气中的水蒸气
(3)F ?(4)蓝色? 2 Br-+Cl2=2Cl-+Br 2
(5)Cl2+2OH-=Cl-+ClO-+H2O?
(6)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
MnCl2+Cl2↑+2H2O随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
本题解析:(1)由装置图示可知:A是分液漏斗;B是圆底烧瓶。(2)用浓HCl与MnO2在加热条件下发生反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制取氯气。由于浓盐酸有挥发性,所以在氯气中含有杂质HCl。由于氯气在饱和食盐水中的溶解度小,所以为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水。此时产生的氯气中任然含有水蒸气。用浓硫酸来干燥。因此D中浓H2SO4的作用是除去氯气中的水蒸气。(3)氯气没有漂白性,当氯气遇水时二者发生反应产生HClO,有漂白性。因此E中红色干布条不褪色,F中红色湿布条褪色。(4)G是浸有淀粉KI溶液的棉花球,氯气会与KI发生反应:2 I-+Cl2=2Cl-+I 2,I 2遇淀粉变为蓝色。因此G处现象是棉花球表面变成蓝色。H是浸有NaBr溶液的棉花球,由于活动性Cl2>Br 2。所以H处反应的离子方程式是2 Br-+Cl2=2Cl-+Br 2。(5)氯气是大气污染物,所以在排放前应该进行尾气处理。由于氯气能与碱发生反应,所以若P处为尾气吸收装置,实验室利用烧碱溶液吸取Cl2的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O。(6)在B中发生的实验室制取氯气的反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O制取氯气。由于浓盐酸有挥发性,所以在氯气中含有杂质HCl。由于氯气在饱和食盐水中的溶解度小,所以为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水。此时产生的氯气中任然含有水蒸气。用浓硫酸来干燥。因此D中浓H2SO4的作用是除去氯气中的水蒸气。(3)氯气没有漂白性,当氯气遇水时二者发生反应产生HClO,有漂白性。因此E中红色干布条不褪色,F中红色湿布条褪色。(4)G是浸有淀粉KI溶液的棉花球,氯气会与KI发生反应:2 I-+Cl2=2Cl-+I 2,I 2遇淀粉变为蓝色。因此G处现象是棉花球表面变成蓝色。H是浸有NaBr溶液的棉花球,由于活动性Cl2>Br 2。所以H处反应的离子方程式是2 Br-+Cl2=2Cl-+Br 2。(5)氯气是大气污染物,所以在排放前应该进行尾气处理。由于氯气能与碱发生反应,所以若P处为尾气吸收装置,实验室利用烧碱溶液吸取Cl2的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O。(6)在B中发生的实验室制取氯气的反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若实验中使用12 mol/L的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,是因为随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
MnCl2+Cl2↑+2H2O。若实验中使用12 mol/L的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,是因为随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
本题难度:一般