1、填空题 有一透明溶液,可能含有大量的NH4+、 Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32 -中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如下图所示。
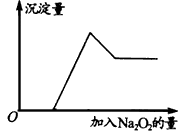
推断:
(1)溶液中一定含有的离子是____________。
(2)溶液中肯定不含有的离子是______________。
(3)可能含有的离子是_________________。
参考答案:(1)Mg2+ .Al3+ .H+ .SO42-
(2)CO32- .NH4+ .Cu2+ .Fe3+
(3)Na+
本题解析:
本题难度:一般
2、填空题 为达到预期的实验目的,下列操作正确的是
[? ]
A.配制0.1mol/L的盐酸500mL,应选用的仪器有胶头滴管、烧杯、玻璃棒、天平、500mL容量瓶
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.测定硫酸铜晶体中结晶水含量, 加热坩埚中晶体完全失水后需在空气中冷却,再称量
参考答案:C
本题解析:
本题难度:一般
3、填空题 有一包粉末,其中可能含有Na2CO3、NaHCO3、NaCl、K2SO4、Na2SO4和BaCl2,现按下列步骤进行实验。
(1)将该粉末溶于水,溶液变浑浊,过滤,得滤液和白色沉淀。
(2)向操作(1)中得到的白色沉淀中加入足量的稀HNO3后,沉淀量减少但不完全消失。
(3)向操作(1)得到的滤液中滴加NaOH溶液,有白色沉淀产生。
(4)取操作(1)得到的滤液做焰色反应,火焰呈黄色,透过蓝色钴玻璃观察,未见紫色火焰。
由上述实验现象推断:混合物中一定含有_______;一定不含有______;不能肯定是否含有________。
参考答案:Na2CO3 、NaHCO3 、BaCl2 、Na2SO4 ;K2SO4;NaCl
本题解析:
本题难度:一般
4、选择题 15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68LH2(标准状况),加入KSCN溶液后,无颜色变化.为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL3mol/LNaOH溶液,则原硫酸溶液的物质的量浓度为( )
A.4mol?L-1
B.3mol?L-1
C.2mol?L-1
D.1mol?L-1
参考答案:发现固体完全溶解,铁和氧化铁均无剩余,铁元素在反应后的溶液中以Fe2+形式存在,为了中和过量的硫酸,而且使铁完全转化成Fe(OH)2,共消耗3mol/L的NaOH溶液200mL,反应后的溶液溶质只有Na2SO4,
根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=12n(NaOH),
则有:n(H2SO4)=n(Na2SO4)=12n(NaOH)=12×3mol/L×0.2L=0.3mol,
c(H2SO4)=0.3mol0.15L=2mol/L,
故选C.
本题解析:
本题难度:简单
5、选择题 某无色溶液,由Na+、Ca2+、Al3+、Cu2+、AlO2-、CO32-、SO32-、SO42-中的若干种组成.取适量该溶液进行如下实验:①加入过量盐酸,有无色、无味气体X生成;②在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液并加热,有刺激性气味的气体Y生成,并析出白色沉淀乙.则下列判断正确的是( )
A.原溶液中一定存在的离子是Na+、AlO2-、CO32-
B.原溶液中一定存在的离子是Al3+、SO42-、CO32-
C.白色沉淀甲为Al(OH)3、乙为BaSO4
D.气体X为CO2、气体Y为SO2
参考答案:该溶液为无色溶液,说明没有Cu2+;
①取适量试液,加入稍过量盐酸,有无色无味的气体生成,说明有CO32-,生成CO2,离子方程式为:2H++CO32-═H2O+CO2↑,由离子的共存可知没有有Al3+,Ca2+,SO32-,
再根据溶液的电中性,必须有阳离子,所以存在Na+;
②在①所得溶液中再加入过量碳酸氢铵溶液,与与残余HCl反应,有气体生成,同时析出白色沉淀,说明有AlO2-,先与①步中的H+反应生成Al3+,生成的Al3+在第二步中
再与HCO3-反应生成Al(OH)3白色沉淀,反应的离子方程式为:AlO2-+4H+═Al3++2H2O,Al3++3HCO3-═Al(OH)3↓+3CO2↑;
③在②所得溶液中加入过量Ba(OH)2溶液,并有白色沉淀乙析出,由于溶液②中加了过量碳酸氢铵,所以刺激性气味的气体为NH3,沉淀Y肯定有BaCO3,离子方程式为
HCO3-+OH-═CO32-+H2O,CO32-+Ba2+═BaCO3↓,至于是否有SO42-,无法判断,还要继续试验.
所以该溶液中一定有Na+、AlO2-,CO32-,一定没有Ca2+、Al3+、Cu2+、SO32-,可能有SO42-;白色沉淀甲为Al(OH)3,乙为BaCO3,可能有BaSO4;气体X为CO2,气体Y为NH3.
故选A.
本题解析:
本题难度:一般