|
高考化学知识点总结《能量的相互转化》高频试题特训(2019年最新版)(二)
2019-03-14 22:53:01
【 大 中 小】
|
1、选择题 分析右面的能量变化示意图,确定下列选项中正确的是( )
A.2A(g)+B(g)=2C(g);△H<0
B.2A(g)+B(g)=2C(g);△H>0
C.2A+B=2C;△H<0
D.2C=2A+B;△H<0
| 
参考答案:由图象知,2A+B的能量小于2C的能量,根据化学反应前后能量守恒,如果A、B为反应物,C为生成物,2A(g)+B(g)═2C(g)时该反应放出能量,△H<0;如果C为反应物,A、B为生成物,2C(g)═2A(g)+B(g)时该反应吸收能量,△H>0.
故选A.
本题解析:
本题难度:一般
2、选择题 已知:物质的能量越低越稳定,白磷转化为红磷是放热的,据此下列说法中正确的是(? )
A.白磷转化为红磷是物理变化
B.在相同条件下红磷比白磷稳定
C.相同条件下,红磷所具有的总能量比白磷的高
D.相同质量的红磷和白磷完全燃烧放出的能量相等
参考答案:B
本题解析:白磷转化为红磷是放热反应,说明白磷的能量高于红磷的,所以红磷比白磷稳定。同素异形体之间的转化属于化学变化。既然白磷的能量高于红磷的,所以相同质量的红磷和白磷完全燃烧放出的能量不相等,白磷放出的能量要高于红磷放出的能量。答案是B。
本题难度:一般
3、填空题 某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 ? g。?
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): ? 。?
名称
| 托盘天平
(带砝码)
| 小烧杯
| 坩埚钳
| 玻璃棒
| 药匙
| 量筒
| 仪器
| 
| 
| 
| 
| 
| 
| 序号
| a
| b
| c
| d
| e
| f
|
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
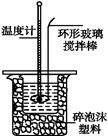
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) ? ? ? ?。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
温度
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
| 温度差
平均值
(t2-t1)/℃
| H2SO4
| NaOH
| 平均值
| 1
| 26.2
| 26.0
| 26.1
| 29.6
| ?
| 2
| 27.0
| 27.4
| 27.2
| 31.2
| ?
| 3
| 25.9
| 25.9
| 25.9
| 29.8
| ?
| 4
| 26.4
| 26.2
| 26.3
| 30.4
| ?
|
?
①上表中的温度差平均值为 ?℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= ?(取小数点后一位)。?
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。?
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)5.0(1分)
(2)a、b、e(2分)
Ⅱ.(1)1/2H2SO4(aq)+ NaOH(aq) 1/2Na2SO4(aq)+ H2O(l) ΔH="-57.3" kJ·mol-1(2分) 1/2Na2SO4(aq)+ H2O(l) ΔH="-57.3" kJ·mol-1(2分)
(2)①4.0(2分) ②-53.5 kJ·mol-1(2分) ③a、c、d(2分)
本题解析:Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.5L×40g/mol=5.0g。
(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,故答案为:a b e 。
Ⅱ.(1)中和热为酸碱中和生成1mol H2O时的焓变,所以表示稀硫酸和稀氢氧化钠中和热的热化学方程式为:1/2H2SO4(aq)+ NaOH(aq)=1/2Na2SO4(aq)+ H2O(l) ΔH="-57.3" kJ·mol-1
(2)①第2组数据明显有误,所以删掉,其它三组数据求平均值,温度差平均值=【(30.1?26.1)+(29.8?25.9)+(30.4?26.3)】÷3=4.0°C。
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m?c?△T=80g×4.18J/(g?℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-1.3376kJ÷0.025mol=--53.5 kJ·mol-1。
③a、实验装置保温、隔热效果必须好,否则影响实验结果,正确;b、量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,错误;c、尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,正确;d、用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,正确。
本题难度:一般
4、选择题 下列说法中,错误的是(?)
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
参考答案:D
本题解析:人体内无时无刻都在进行成千上万的化学反应,由它们来提供运动所需的能量
本题难度:简单
5、选择题 已知反应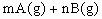  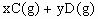 ,A的转化率 ,A的转化率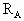 与p、T的关系如图,根据图示可以得出的正确结论是 ? 与p、T的关系如图,根据图示可以得出的正确结论是 ?
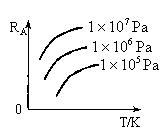
A.正反应放热
B.正反应吸热
C.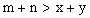
D.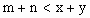
参考答案:BC
本题解析:略
本题难度:简单
| 
