1、选择题 化学反应中的能量变化是化学工作者一直关心和研究的课题。下列有关说法不正确的是
[? ? ]
A.化学反应中总是存在着能量的变化,有放热反应和吸热反应之分
B.化学反应中只要是有能量释放的反应,就可以设计成原电池
C.充电反应中,阳极发生氧化反应
D.一个可逆反应在一定条件下达到平衡状态,升温,平衡移动的方向需看反应的热效应
参考答案:B
本题解析:
本题难度:简单
2、选择题 对于放热反应H2+Cl2
2HCl,下列说法中,正确的是( )
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成1molH-Cl键所放出的能量
D.该反应中,化学能只转变为热能
参考答案:该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;放热反应的本质是:生成物成键释放的总能量大于反应物断键吸收的总能量,故选B
本题解析:
本题难度:简单
3、选择题 已知某温度下: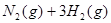

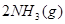 ?△H=
?△H=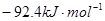 ,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是(?)
,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是(?)
A、A中放热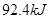 ?
?
B、B中放热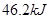 ?
?
C、A中热量变化值大于B中2倍?
D、A中热量变化值等于B中的2倍
参考答案:C
本题解析:A、B均不正确,反应热是反应完全进行所放出或吸收的热量,反应是可逆反应,不能完全进行。C、正确,A相当于对B加压后体积放大2倍,平衡正向进行,反应正向进行程度大,所以A中热量变化值大于B中2倍,D不正确。选C。
本题难度:一般
4、选择题 下列说法正确的是( )
A.已知:H2(g)+ O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2
C.已知: H2SO4(浓)+NaOH(aq)="=="
H2SO4(浓)+NaOH(aq)="=="  Na2SO4(aq)+H2O(l) ΔH1;
Na2SO4(aq)+H2O(l) ΔH1;
CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2|
D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1
 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1