1、选择题 银器皿日久表面逐渐变黑,这是因为生成了Ag2S.有人设计用原电池原理除去银器表面的黑色.方法为:将其与Al片接触,一起浸泡在稀NaOH溶液中,放置一段时间后黑色褪去,取出用水洗净,恢复其原貌.总反应为2Al+3Ag2S+8OH-═2AlO
+6Ag+3S2-+4H2O
下列叙述不正确的是( )
A.反应后溶液的pH降低
B.溶液中的OH-离子向正极移动
C.负极的电极反应式为:2Al+8OH--6e-═2AlO+4H2O
D.正极的电极反应式为:3Ag2S+6e-=═6Ag+3S2-
参考答案:A.根据2Al+3Ag2S+8OH-═2AlO2-+6Ag+3S2-+4H2O知,氢氧根离子参加反应,所以氢离子浓度逐渐降低,溶液的pH逐渐减小,故A正确;
B.原电池放电时,氢氧根离子向负极移动,故B错误;
C.根据电池反应式知,负极上失电子发生氧化反应,所以发生的电池反应式为2Al+8OH--6e-═2AlO2-+4H2O,故C正确;
D.根据电池反应式知,正极上得电子发生还原反应,所以发生的电池反应式为3Ag2S+6e-=═6Ag+3S2-,故D正确;
故选B.
本题解析:
本题难度:简单
2、简答题 将0.3mol?NaCl固体与0.1mol?CuSO4?5H2O固体混合溶于水,配成1000mL混合液.然后取出200ml溶液,用石墨作电极,通电一段时间.电解过程分为三个阶段试回答:
(1)其中第一阶段发生的电解反应的离子方程式为______.
(2)电解的最后一个阶段,阴 极上发生的电极反应式变为______.
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积______L(标准状况下)
参考答案:根据题意知,取出的溶液中含有的溶质的物质的量分别为:NaCl0.06mol,CuSO40.02mol;溶液中阴阳离子的放电顺序分别为:阳离子放电顺序Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-
所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
(1)根据以上分析知,第一阶段的电解反应为Cu2++2Cl-?电解?.?Cu+Cl2
故答案为Cu2++2Cl-?电解?.??Cu+Cl2
(2)电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
故答案为:2H++2e-═H2↑
(3)当铜离子全部生成铜单质时,根据得失电子相等知,氯离子还剩0.02mol.
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-
? 2? 22.4L
0.02mol?0.224L?
故答案为?0.224L.
本题解析:
本题难度:一般
3、选择题 如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
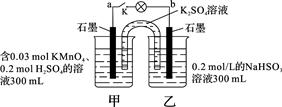
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
参考答案:C
本题解析:A.n(e-)=1.204×1022÷6.02×1023=0.02mol.则在乙烧杯中发生反应的NaHSO3的物质的量为0.01mol。产生的H+的物质的量为0.01mol。c(H+)=0.01mol÷0.1L=0.1mol/L。溶液中的H+主要是由NaHSO3反应产生。所以pH=1正确。B.在该原电池反应中,乙池的石墨电极为负极,甲池的石墨电极为正极。根据同种电荷相互排斥,异种电荷相互吸引的原则,电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a。正确。C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,溶液中的c(H+)不断减小,所以由水电离出的c(H+)逐渐增大。错误。D.在乙池中HSO3-不断被氧化,变为SO42-。因此该烧杯的氧化产物为SO42-。
本题难度:一般
4、选择题 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag++e-=Ag
④盐桥内的K+移向AgNO3溶液.
A.②④
B.①②
C.②③
D.③④
参考答案:原电池中,较活泼的金属铜作负极,负极上金属铜失去电子发生氧化反应,较不活泼的金属银作正极,正极上银离子得电子发生还原反应,外电路上,电子从负极沿导线流向正极,
①实验过程中取出盐桥,不能构成闭合回路,所以原电池不能继续工作,故错误;
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同,故正确;
③正极上得电子发生还原反应,所以反应为:Ag++e-=Ag,故错误;
④盐桥中钾离子向正极AgNO3溶液移动,故正确;
故选A.
本题解析:
本题难度:简单
5、填空题 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
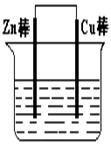
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 ,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: 。
参考答案:(10分)(1)负极(2分)有气泡生成(或有气体放出)(2分);2H++2e-=H2↑(2分)
(2)还原 (2分) Zn-2e-=Zn2+ (2分)
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,电极反应式是2H++2e-=H2↑,所以实验现象是有气泡生成(或有气体放出)。
(2)若电解质为硫酸铜溶液,则溶液中的铜离子在正极得到电子,发生还原反应。而锌仍然是负极,失去电子,电极反应式是Zn-2e-=Zn2+。
考点:考查原电池的有关判断以及电极反应式的书写
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般