1、选择题 银器皿日久表面逐渐变黑,这是因为生成了Ag2S.有人设计用原电池原理除去银器表面的黑色.方法为:将其与Al片接触,一起浸泡在稀NaOH溶液中,放置一段时间后黑色褪去,取出用水洗净,恢复其原貌.总反应为2Al+3Ag2S+8OH-═2AlO
+6Ag+3S2-+4H2O
下列叙述不正确的是( )
A.反应后溶液的pH降低
B.溶液中的OH-离子向正极移动
C.负极的电极反应式为:2Al+8OH--6e-═2AlO+4H2O
D.正极的电极反应式为:3Ag2S+6e-=═6Ag+3S2-
2、简答题 将0.3mol?NaCl固体与0.1mol?CuSO4?5H2O固体混合溶于水,配成1000mL混合液.然后取出200ml溶液,用石墨作电极,通电一段时间.电解过程分为三个阶段试回答:
(1)其中第一阶段发生的电解反应的离子方程式为______.
(2)电解的最后一个阶段,阴极上发生的电极反应式变为______.
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积______L(标准状况下)
3、选择题 如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
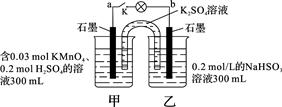
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
4、选择题 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag++e-=Ag
④盐桥内的K+移向AgNO3溶液.
A.②④
B.①②
C.②③
D.③④
5、填空题 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
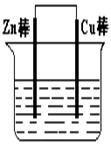
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 ,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: 。