1、选择题 原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-=Al3+
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
参考答案:C
本题解析:
C不正确,由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-=Fe2+
铁的还原性强于铜,铁作负极。
本题难度:困难
2、选择题 银器皿日久表面逐渐变黑,这是因为生成了Ag2S.有人设计用原电池原理除去银器表面的黑色.方法为:将其与Al片接触,一起浸泡在稀NaOH溶液中,放置一段时间后黑色褪去,取出用水洗净,恢复其原貌.总反应为2Al+3Ag2S+8OH-═2AlO
+6Ag+3S2-+4H2O
下列叙述不正确的是( )
A.反应后溶液的pH降低
B.溶液中的OH-离子向正极移动
C.负极的电极反应式为:2Al+8OH--6e-═2AlO+4H2O
D.正极的电极反应式为:3Ag2S+6e-=═6Ag+3S2-
参考答案:A.根据2Al+3Ag2S+8OH-═2AlO2-+6Ag+3S2-+4H2O知,氢氧根离子参加反应,所以氢离子浓度逐渐降低,溶液的pH逐渐减小,故A正确;
B.原电池放电时,氢氧根离子向负极移动,故B错误;
C.根据电池反应式知,负极上失电子发生氧化反应,所以发生的电池反应式为2Al+8OH--6e-═2AlO2-+4H2O,故C正确;
D.根据电池反应式知,正极上得电子发生还原反应,所以发生的电池反应式为3Ag2S+6e-=═6Ag+3S2-,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 现有下列四个小实验,简要实验步骤及现象如下
①在紫色的KMnO4酸性稀溶液中,逐滴滴入过氧化氢溶液,溶液温度变化不大,但褪色速率越来越快
②将化学荧光棒[外层是塑料管放草酸二苯酯(还原剂)及发光颜料,内玻璃管中放入4%过氧化氢溶液]弯曲,内管断裂,液体混合,发出五颜六色的光。
③两根外形相同的铁棒和锡棒紧靠,放入稀硫酸中,发现一根棒的表面有气泡产生
④正在烧煤球的煤炉中,滴上几滴水,立刻串出火苗
下列分析正确的是(?)
A.实验①中,反应生成的Mn2+可能是该反应的催化剂
B.实验②中,该反应是太阳能转变为光能
C.实验③中,有气泡产生的棒是铁棒
D.实验④中,加入的水是反应的催化剂,且该反应能自发进行
参考答案:A
本题解析:选项B不正确,应该是化学能转化为光能;铁的金属性强于锡的,所以铁是负极,锡是正极,氢气在正极生成,选项C不正确;选项D正确,高温下水与碳反应生成氢气和CO,氢气和CO都是可以燃烧的,所以正确的答案选A。
本题难度:一般
4、选择题 右上图是一原电池的装置,关于它的说法正确的是
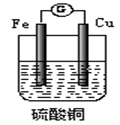
A.装置中铜是负极
B.铜表面的反应为:2H++2e-=H2↑
C.电流的方向是从铁经导线流向铜
D.构成原电池后,铁与硫酸铜的反应速率加快
参考答案:D
本题解析:
A.不正确,装置中铜是正极; B.不正确,铜表面的反应为:Cu2+++2e-="Cu;" C.不正确,电流的方向是从铜经导线流向铁; D.正确。选D。
本题难度:一般
5、填空题 请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=?(要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是?(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
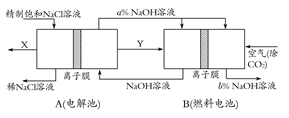
①图中X、Y分别是?、?(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小?;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极:?;负极:?;
③这样设计的主要节(电)能之处在于(写出2处)?、?。
参考答案:(1)k=Mr(Cl2)/2Mr(NaOH)=71/80=1∶1.13或0.89
(2)③①②
(3)①Cl2 H2 a%<b%
②O2+4e-+2H2O=4OH-?H2-2e-+2OH-=2H2O
③燃料电池可以补充电解池消耗的电能 提高产出碱液的浓度,降低能耗(其他合理答案也可)
本题解析:(1)据化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可计算出k值.
2NaOH+H2↑+Cl2↑即可计算出k值.
(2)把Na2CO3放在BaCl2之后,以除去过量的Ba2+;把盐酸放在NO2CO3之后,以除去过量的CO32-。
(3)判断出二极是解答二池问题的前提:燃料电池中通空气(氧化剂)的一极应为正极,所以:①Y(通入负极,还原剂)必为H2,继而H2产生于电解池的阴极,可推出产生于电解池阳极的X必为Cl2;a% NaOH进入燃料电池,出来后的浓度变化可用二种方法判断:[方法一]从Na+的移动方向来定:Na+向阴极(即正极)移动,所以正极b% NaOH浓度增大,负极流出的NaOH变稀;[方法二]从水、OH-的量变来定:负极H2-2e-+2OH-=2H2O,水增多、OH-减少,变稀;正极O2+4e-+2H2O=4OH-,水减少、OH-增多,所以正极增浓,即a<b。
本题难度:一般