| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《盐类水解的原理》考点特训(2019年冲刺版)(六)
参考答案:BD 本题解析:CH3COONa 溶液中存在:CH3COO-+H2O 本题难度:一般 3、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是 |
参考答案:C
本题解析:A、pH=4的醋酸中:c(H+)=10—4mol·L-1,错误;B、根据物料守恒知,饱和小苏打溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),错误;C、根据电荷守恒知,饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、50℃时Kw>1×10-14,pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol?L-1,错误。
考点:考查pH计算、溶液中离子浓度大小关系。
本题难度:一般
4、填空题 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。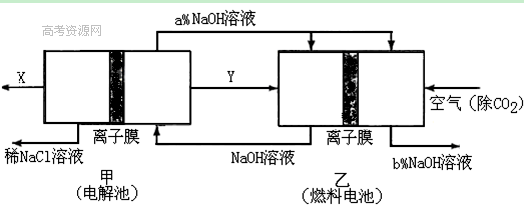
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%
参考答案:
本题解析:
本题难度:困难
5、选择题 200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+c(OH-)= c(CH3COO-)+c(H+)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A
本题解析:试题分析:200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,相当于400mL0.1 mol·L-1CH3COONa溶液,A、正确,物料守恒,钠元素的总量与醋酸的各种存在形态相当;B、D不正确,CH3COO―少量水解,溶液呈碱性,c(CH3COO-)>c(OH-),应为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C、不正确,由电荷守恒可知:c(Na+)+c(H+)= c(CH3COO-)+c(OH-);选A。
考点?:电解质溶液中离子浓度间关系及大小比较
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《原电池原理.. | |