1、选择题 用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
A.溶液的pH变大
B.c(Na+)与c (CO32-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出
参考答案:D
本题解析:试题分析:电解饱和Na2CO3溶液,实际是电解水。一段时间后,随着水的减少,饱和溶液中会有晶体析出。根据公式: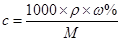 ,因为电解前后,此溶液均为饱和溶液,故其浓度保持不变,因此答案选D。
,因为电解前后,此溶液均为饱和溶液,故其浓度保持不变,因此答案选D。
考点:电解质溶液;水解;溶液浓度
点评:本题是对电解质溶液的综合考查。对于溶液的浓度,应牢记此公式: 。同时,对于饱和溶液,由于水的减少,会导致晶体的析出。
。同时,对于饱和溶液,由于水的减少,会导致晶体的析出。
本题难度:困难
2、填空题 (4分)水的电离平衡如图所示.
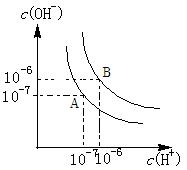
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为
(2)将100℃时p H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 
参考答案: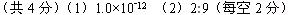
本题解析:略
本题难度:一般
3、填空题 下列物质溶解于水中,能促进水的电离的是
[? ]
A.H2SO4
B.Ba(OH)2
C.KNO3
D.Na2CO3
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列操作中,能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入NaOH溶液
D.将水加热到100℃,使pH=6
参考答案:A、硫酸氢钠的电离:NaHSO4=Na++H++SO42-,硫酸氢钠溶液相当于稀硫酸,对水的电离起抑制作用,故A错误;
B、向水中加入硫酸铝溶液,铝离子水解促进水的电离,铝离子和氢氧根离子生成氢氧化铝,使溶液中氢离子浓度大于氢氧根离子浓度,所以溶液呈酸性,故B正确;
C、向水中加入氢氧化钠溶液,氢氧根离子抑制水的电离,溶液中氢氧根离子浓度大于氢离子浓度,所以溶液呈碱性,故C错误;
D、水的电离是吸热反应,升高温度能促进水的电离,使平衡向正反应方向移动,但溶液中氢离子浓度和氢氧根离子浓度仍然相等,溶液呈中性,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性