1、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1L0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.lmol·L-1溶液中pH=l
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaC12反应产生沉淀
参考答案:D
本题解析: A、Ka(HF)=3.6×10-4,知其为弱酸,不可能完全电离,错误;B、Ksp(CaF2)与浓度无关,错误;C、混合后溶液中Ca2+浓度为0.1mol·L-1,F-浓度为 =0.6×10-2,浓度商为0.6×10-3> Ksp(CaF2)=1.46×10-10,会与沉淀出现,错误。D、正确。
=0.6×10-2,浓度商为0.6×10-3> Ksp(CaF2)=1.46×10-10,会与沉淀出现,错误。D、正确。
本题难度:一般
2、填空题 (12分)某湖泊底部为石灰石(CaCO3)质,假设湖水中只溶有少量CO2。
⑴写出CaCO3的溶解平衡平衡表达式: 。
⑵当大气中CO2含量升高时,CaCO3可能发生的变化是 (用化学方程式表示)。

实验编号
| c(NaOH)mol/L
| V(NaOH)mL
| V(强酸)mL
|
1
| 0.1154
| 25.72
| 25.09
|
2
| 0.1154
| 26.70
| 25.00
|
3
| 0.1154
| 26.79
| 25.09
|
4
| 0.1154
| 26.71
| 25.00
|
则该溶液中的c(H+)= mol/L。
参考答案:(12分)
(1)CaCO3(s)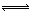 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)
(2)CaCO3+H2O+CO2=Ca(HCO3)2
(3)2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)Al(OH)3,在弱酸性条件下氧化铝溶解为铝离子,Al3++3H2O 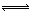 Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
(5)0.1232 本题每空2分
本题解析:(1)少量CaCO3固体溶解得到Ca2+和CO32?,所以表达式为:CaCO3(s)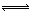 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)
(2)多元弱酸和其正盐反应生成酸式盐,所以当大气中CO2含量升高时,CO2、H2O与CaCO3发生反应,生成Ca(HCO3)2,化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2
(3)H2SO3的K1、K2均大于H2CO3的K2,H2SO3的K2小于H2CO3的K1,所以SO2、H2O与CaCO3反应生成Ca(HCO3)2和CaSO3,化学方程式为:2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)花岗岩的成分含有Al2O3,当湖水的pH降低到5.0时,为弱酸性,Al2O3与H+反应生成Al3+,Al3+能发生水解反应:Al3++3H2O 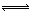 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
(5)第一组数据与其它数据相差较大,实验出现了操作错误,应舍去,由2、3.4求出H+浓度的平均值,为0.1232mol/L
考点:本题考查方程式的书写、盐类水解的应用、实验数据的处理。
本题难度:困难
3、选择题 下述实验设计能够达到目的的是
参考答案:
本题解析:
本题难度:一般
4、填空题 工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
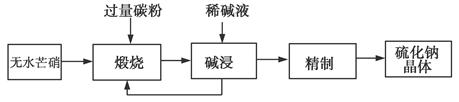
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
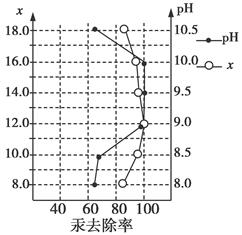
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
参考答案:(1)3Na2SO4+8C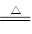 3Na2S+4CO2↑+4CO↑
3Na2S+4CO2↑+4CO↑
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解
(3)pH介于9~10之间,x=12
(4)4.0×10-36 mol/L
(5)阴极 降低
2Cu2++2e-+H2O=Cu2O↓+2H+
本题解析:(1)由题意分析知反应除生成等物质的量的CO和CO2外还生成Na2S,注意条件为加热。(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解。(3)由图像可知当pH介于9~10时,x=12时汞的除去率最大。(4)pH=4,则c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可求得c(Cu2+)=2.2 mol/L,代入CuS的溶度积求得c(S2-)=4×10-36 mol/L。(5)Cu由+2价变为+1价,得电子,所以在阴极反应:2Cu2++2e-+H2O=Cu2O↓+2H+,有H+生成,所以溶液的pH降低。
点拨:本题考查化学与技术,考查考生理论联系实际的能力。难度较大。
本题难度:困难
5、选择题 关于溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),下列说法中正确的是( )
A.加入固体Mg(OH)2,可以增大溶液中镁离子的浓度
B.溶度积常数表示式:KSP=c(Mg2+)?c(OH-)2
C.加入NaOH浓溶液,可以增加Mg(OH)2的溶解量
D.升高温度,不会影响溶解平衡
参考答案:A、加入固体Mg(OH)2,平衡不移动,镁离子的浓度不变,故A错误;
B、根据溶度积常数的概念书写,溶度积常数表示式:KSP=c(Mg2+)?c(OH-)2;故B正确;
C、加入NaOH浓溶液,使溶解平衡逆移,Mg(OH)2的溶解量减小,故C错误;
D、升高温度溶解度增大,溶解平衡正移,故D错误;
故选:B.
本题解析:
本题难度:一般