1、选择题 把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式的说 法正确的是

A.配平后的化学计量数依次为3、1、2、6、3
B.若有1 mol的S被氧化,可生成2 molS2-
C.氧化剂与还原剂的物质的量之比为1:2
D.2 mol S参加反应转移3 mol电子
参考答案:B
本题解析:
本题难度:一般
2、选择题 (NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
A.SO2、H2O、N2、NH3
B.H2O、SO2、N2、NH3
C.N2、SO2、NH3、H2O
D.H2O 、NH3、SO2、N2
参考答案:C
本题解析:(NH4)2SO4在高温下分解,产物是SO2、H2O、N2
即:(NH4)2SO4--------> N2 + SO2 + NH3 + H2O
NH4+由-3 →0,失去3个电子,由于N2分子含两个N,所以失去3×2=6个电子。
SO42-由+6→+4得到2个电子,所以SO42-×3,得到3×2=6个电子。
3(NH4)2SO4→N2 + 3SO2 + NH3 + H2O
到了这一步就差不多。。6个NH4+,有2个转化为N2,剩下4个没有发生氧化还原反应,于是:
3(NH4)2SO4→ N2 + 3SO2 +4NH3 + H2O,然后计算一下氢的数量,3×(4×2)-4×3=12。
所以H2O有6个,当然也可以用SO42-失去的氧计算。
最终得到:
3(NH4)2SO4==高温="=" N2 + 3SO2 +4NH3 + 6H2O。故选C。
点评:本题考查的是氧化还原反应的应用,此题要根据电子转移守恒即化合价升高降低一致来配平。
本题难度:一般
3、填空题 (1)用“单线桥”表示下列反应电子转移的方向和数目:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
反应中物质的氧化性:KMnO4______Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为______.
(2)配平下列氧化还原反应方程式:
______KMnO4+______H2S+______H2SO4(稀)--______K2SO4+______MnSO4+______S↓+______H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2
若反应中NH3消耗6.8g,则转移电子个数为______.
参考答案:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表示反应中电子转移的方向和数目为:
,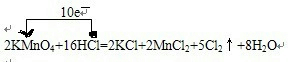 ,反应中化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,高锰酸钾是氧化剂,氯气是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:KMnO4>Cl2,氧化产物是氯气,还原产物是氯化锰,它们的物质的量之比为5:2,
,反应中化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,高锰酸钾是氧化剂,氯气是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:KMnO4>Cl2,氧化产物是氯气,还原产物是氯化锰,它们的物质的量之比为5:2,
故答案为: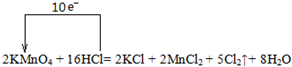 ;>;5:2;
;>;5:2;
(2)在反应中,Mn元素化合价降低了5价,硫元素的化合价升高了2价,根据电子守恒,所以锰元素的前边系数都是2,硫化氢前边系数是5,根据原子守恒,硫酸钾的前边系数是1,硫酸锰前边系数是2,根据S守恒,硫酸前边系数是3,水前边系数为8,即2KMnO4+5H2S+3H2SO4(稀)═1K2SO4+2MnSO4+5S↓+8H2O,
故答案为:2、5、3、1、2、5、8;
(3)反应3Cl2+8NH3=6NH4Cl+N2中,化合价升高数=化合价降低数=转移电子数=6,即反应中NH3消耗8mol,则转移电子6mol,当反应中NH3消耗6.8g,则转移电子个数为0.3NA或1.806×1023个,故答案为:0.3 NA或1.806×1023个.
本题解析:
本题难度:简单
4、填空题 【化学—选修2:化学与技术】(15分)
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
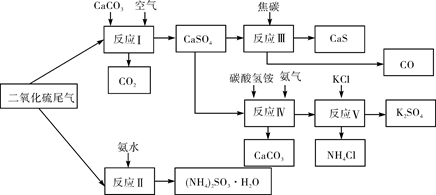
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥