1、选择题 金属钾在氧气中燃烧能生成超氧化钾(KO2),KO2与CO2或水作用均生成O2。现将一定量钠钾合金在足量氧气中燃烧,将反应产物置于水中并通入足量的CO2,充分反应后,最多放出O2的体积是最多吸收CO2的体积的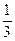 ,则原钠钾合金中钠与钾的质量之比为(? )
,则原钠钾合金中钠与钾的质量之比为(? )
A.23∶36
B.46∶39
C.115∶39
D.23∶78
参考答案:C
本题解析:根据反应:K—KO2—CO2—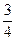 O2;Na—
O2;Na—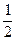 Na2O2—CO2—
Na2O2—CO2—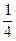 O2的关系可算出答案。
O2的关系可算出答案。
本题难度:简单
2、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
 SiO2 +
SiO2 + C+
C+ N2
N2
 Si3N4+
Si3N4+ CO
CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___________,其还原产物是___________;
(3)该反应的平衡常数表达式为K=___________;
(4)若知上述反应升高温度,其平衡常数值减小,则该反应的反应热ΔH______零(填“大于”、“小于”或“等于”);
参考答案:(1) (2)N2;Si3N4
(2)N2;Si3N4
(3)c6(CO)/c2(N2)
(4)小于
本题解析:
本题难度:一般
3、选择题 新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
参考答案:B
本题解析:A、根据方程式2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O可知,铁元素的化合价从+3价升高到+6价,失去3个电子,被氧化,因此氯化铁是还原剂。氯元素的化合价从+1价降低到-1价,得到2个电子,被还原,所以次氯酸钠是氧化剂,即反应①是氧化还原反应。而反应②是离子间相互交换成分,生成另外一种盐和另外一种碱,因此是复分解反应,A正确;B、反应①中氧化产物是高铁酸钠,还原产物是氯化钠。由于还原剂与氧化剂的物质的量之比是2:3,因此反应中氧化产物与还原产物物质的量之比为2:3,B不正确;C、反应②的产物K2FeO4中Fe为+6价,价态高,易得到电子,具有强氧化性,能杀菌消毒,C正确;D、铁元素的化合价从+3价升高到+6价,失去3个电子,因此若有2mol FeCl3发生反应,转移电子的物质的量为6 mol,D正确,答案选B。
本题难度:一般
4、简答题 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
(1)配平下列第②个反应,将系数填在横线上.
①NaIO3不足时,发生反应:2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4
②NaIO3足量时,发生反应:______NaIO3+______NaHSO3=______I2+______Na2SO4+______H2SO4+______H2O
(2)现模拟工业制取I2.在含5molNaHSO3的溶液中逐滴加入NaIO3溶液.请画出加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线.
(3)若工业上要生产2.54吨I2,至少需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气多少立方米?
参考答案:(1)化学反应中碘元素化合价从+5价降为0价,生成1mol碘单质共降低10价,硫元素的化合价从+4价升高到+6价,2molNaHSO3生成1molNa2SO4共升高了4价,根据电子守恒和原子守恒,则碘酸钠的前面系数是4,亚硫酸氢钠的系数是10,即4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,故答案为:4;10;2;7;3;2;
(2)根据化学方程式4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O可以知道加入NaIO3的物质的量和析出I2单质的物质的量的关系是2:1,5molNaHSO3消耗2mol碘酸钠时恰好生成碘单质1mol,即
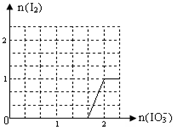
,故答案为:

;
(3)NaOH溶液吸收SO2的反应表示为:SO2+2NaOH=NaHSO3,结合反应4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,可以得到对应关系式:SO2~NaHSO3~0.2I2,假设需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气体积为V,则
SO2~NaHSO3~0.2I2
1?0.2
V?2.54×106254
解得V=5×105(m3)
答:至少需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气5×105m3.
本题解析:
本题难度:一般
5、计算题 (6分)用足量的NaOH溶液将448mlCl2(标准状况)完全吸收,计算①生成的NaClO的物质的量;②该反应中氧化剂与还原剂的物质的量之比;③该反应中电子转移总数。
参考答案:略
本题解析:略
本题难度:一般