|
高考化学知识点整理《物质组成与性质实验方案的设计》练习题(四)
2019-03-14 23:09:54
【 大 中 小】
|
1、实验题 (1)中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次。请你评价若用上述方法制取乙醛存在哪些不足
____________________________(写出两点)
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。填写下列空白?

(2)甲装置常常浸在70~80℃ 的水浴中,目的是________________________。
(3)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为____________________________。
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接___________、___________接丙。
参考答案:(1)操作麻烦、乙醇转化率低(其它合理答案均可)
(2)使生成乙醇蒸气的速率加快
(3)放热;2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O
(4)b;a
本题解析:
本题难度:困难
2、填空题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。
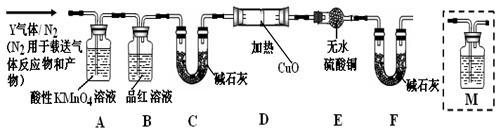
(1)装置B中试剂的作用是?。
(2)认为气体Y中还含有CO2的理由是?(用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于?(选填序号)。
a.. A之前? b . A-B间? c . B-C间? d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是?。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: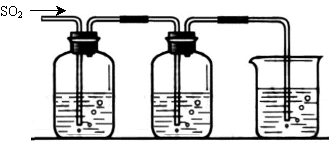
FeCl3溶液 含有淀粉的碘水 ? NaOH溶液
A B C
(5)装置C的作用是 ? ?。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 ? (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯 E.玻璃棒 F. 坩埚
| (7)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 ?(8)能表明I-的还原性弱于SO2的现象是 。
参考答案:(1)检验SO2是否除尽?(2)C +2H2SO4(浓) CO2↑+2SO2↑+2H2O CO2↑+2SO2↑+2H2O
(3)c?(4)D中固体由黑变红和E中固体由白变蓝
(5)吸收SO2尾气,防止污染空气?(6)过滤;? B、F
(7)方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色 (8)B中蓝色溶液褪色
本题解析:(1)A中酸性高锰酸钾溶液是除去SO2的,所以B中品红溶液的作用是可以检验A中是否完全除去SO2。
(2)由于碳素钢中还含有碳元素,也能被浓硫酸氧化生成CO2气体,即反应的化学方程式是C +2H2SO4(浓) CO2↑+2SO2↑+2H2O。 CO2↑+2SO2↑+2H2O。
(3)检验CO2一般用澄清的石灰水,所以要检验CO2的存在,需要在B-C间添加盛有澄清石灰水的M装置,答案选C。
(4)氢气还原氧化铜会生成水蒸气,能使白色的硫酸铜粉末变蓝色。
(5)SO2是大气污染物,所以氢氧化钠溶液的作用是吸收SO2尾气,防止污染空气。
(6)所得得晶体应该通过过滤得到,又因为液体得蒸发浓缩需要蒸发皿,不需要坩埚,且蒸发皿可以直接加热,所以不需要得仪器是BF。
(7)因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,所以方案①不合理。
(8)B中蓝色溶液褪色,说明B中单质点被还原,SO2被氧化,因此能说明I-的还原性弱于SO2的。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难度较大。试题在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导与训练,有利于培养学生的逻辑推理能力和规范的实验设计、操作能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:简单
3、实验题 我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式_____________
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,无水硫酸铜,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)?
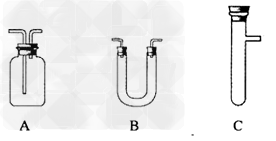
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
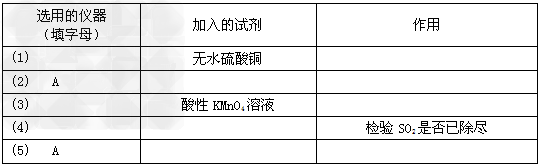
参考答案:(1)2?H2SO4?(浓)?+?C CO2↑+?2?H2O?+?2SO2↑ CO2↑+?2?H2O?+?2SO2↑
(2)
本题解析:
本题难度:一般
4、选择题 配制250mL 0.2mol/L稀H2SO4溶液时,下列操作可能导致浓度偏低的是
A.浓硫酸稀释后,没有冷却直接转移到容量瓶中
B.定容时俯视刻度线
C.转移过程中没有洗涤小烧杯
D.容量瓶洗净后,没有干燥
参考答案:C
本题解析:根据n=c·V可知,浓硫酸稀释后,没有冷却直接转移到容量瓶中,则冷却后容量瓶中溶液的体积减少,浓度偏高;定容时俯视刻度线,则量瓶中溶液的体积减少,浓度偏高;转移过程中没有洗涤小烧杯,则溶质减少,浓度偏低;容量瓶洗净后,没有干燥,不影响,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:简单
5、实验题 (14分)有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图12提供的装置确定该样品的成分及Na2SO3的质量分数。称此样品6.30g,加入6.0mol·L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色。请回答下列问题:
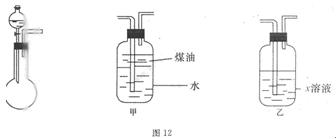
(1)溶液X是?,煤油的作用是?。
(2)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是?,
写出有关离子方程式?。
(3)结合已提供的实验仪器,设计实验(实验仪器自选)如何正确测出气体的体积,简述操作步骤:??
?。
(4)说明一定含有硫酸钠的依据:??
? ?。 ?。
参考答案:(1)X溶液是浓H2SO4(1分),作用是防止SO2与水接触(1分, 其它合理答案参照给分) 其它合理答案参照给分)
(2)50%(2分)SO32-+2H+=SO2↑+H2O(3分)? Ba2++SO42-=BaSO4↓ (2分)
(3)反应装置冷至室温后,再上下移动量筒,使量筒与甲瓶内液面保持水平,然后读取体积。(其它合理答案参照给分,3分)
(4)产生沉淀的物质的量为0.04mol,而加入的硫酸物质的量为0.03mol ,所以必有硫酸钠(其它合理答案参照给分,2分)
本题解析:略
本题难度:一般
|