|
高中化学必备知识点《未知》考点特训(2019年冲刺版)(四)
2019-05-30 02:38:34
【 大 中 小】
|
1、填空题 在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x=?;y=?。
(2)配平该反应的方程式:
FeSO4+?KNO3+?H2SO4=?K2SO4+?Fe2(SO4)3+? ?(NxOy)+?H2O(配平时x、y用具体数值表示,物质填在 ?(NxOy)+?H2O(配平时x、y用具体数值表示,物质填在 中)。 中)。
(3)反应中氧化产物是?。
(4)用双线桥法表示该反应中的电子转移方向和数目:?。
参考答案:(1)1 1 (2)6 2 4 1 3 2 NO↑ 4
(3)Fe2(SO4)3
(4)

+4H2O
本题解析:n(FeSO4)=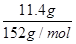 =0.075 mol =0.075 mol
n(KNO3)=0.05 L×0.5 mol·L-1=0.025 mol
Fe2+转化为Fe3+共失去0.075 mol电子,根据得失电子守恒原理,可知1 mol N原子得到3 mol电子,反应中N元素由+5价降为+2价,既得到的氧化物为NO。
本题难度:一般
2、填空题 (1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  ?CO(g)+2H2(g);△H= -36kJ/mol……… ① ?CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………② CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是?____
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲
| 烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______ CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH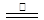 3Na2FeO2+H2O+NH3↑…………①; 3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O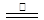 4Na2Fe2O4+3NH3↑……②; 4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平:? __________________
参考答案:(1)①D?②1.35?(2)Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
本题解析:(1)①A.(② -①)×2可得2H2O(g)  O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
本题难度:一般
3、实验题 (17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是:?。请用化学方程式表示滴定的原理:?。
(3)滴定终点的读数为?mL;通过计算可知,该黄铜矿的纯度为?。
(4)若去掉c装置,会使测定结果??(填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有?。
参考答案:(17分) (1)Cu、O(2分,各1分)
(2)酸式(2分);往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出(3分,每个要点给1分);
SO2+I2+2H2O=H2SO4+2HI? (或H2SO3+I2+H2O=H2SO4+2HI)(2分,配平错误扣1分)
(3)20.10(2分,数位错的不给分);80.4%(2分)?(4)偏低(2分)
(5)二氧化硫未能被水充分吸收,亚硫酸部分被氧化(2分,各1分)
本题解析:(1)根据方程式可知铜元素的化合价从+2价降低到0价,氧元素的化合价从化0价降低-2价,被还原。硫元素的化合价从-1价升高到+4价,铁元素的化合价从+2价部分升高到+3价,被氧化。
(2)标准碘溶液显酸性应盛放在酸式滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出。SO2检验还原性能被单质碘氧化,则表示滴定原理的方程式为SO2+I2+2H2O=H2SO4+2HI。
(3)滴定管自上而下刻度逐渐增大,且能精确到0.1mol,所以根据装置图可知滴定终点的读数为20.10?mL;因此根据方程式SO2+I2+2H2O=H2SO4+2HI可知消耗SO2的物质的量是0.05mo1/L×0.02010L=0.001005mol,则原矿石中产生的SO2是0.001005mol×10=0.01005mol,所以根据方程式8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2可知CuFeS2的物质的量是0.01005mol÷2=0.005025mol,其质量为0.005025mol×184g/mol=0.9246g,则该黄铜矿的纯度为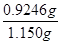 ?×100×=80.4%. ?×100×=80.4%.
(4)铜网的作用是除去未反应的氧气,氧气具有氧化性,如果没有装置c,则导致SO2与碘反应时消耗碘溶液的体积减少,从而导致纯度偏低。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,这说明消耗的标准液碘的体积偏少,因此可能的原因主要有二氧化硫未能被水充分吸收或亚硫酸部分被氧化。
本题难度:一般
4、填空题 氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为:?,原子核外共有?种不同能级的电子,氮原子核外电子云有?种不同的伸展方向,有?种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应?(选填编号)。 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应?(选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化? B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化? D.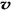 (N2)/ (N2)/ 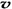 (O2)=2:3 (O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4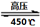 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是?,每分解1mol高氯酸铵,转移的电子数目是?。 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是?,每分解1mol高氯酸铵,转移的电子数目是?。
参考答案:(1) 1s22s22P3 , 3, 4, 7
(2)AB
(3)B
(4) 7∶4? 8NA?或 4.816×1024 个
本题解析:(1)氮元素是7号元素核外电子有7个,排布式为:1s22s22P3?,由于有三种能级,故原子核外共有3种不同能级的电子,氮原子核外电子云有的伸展方向s是球形的只有一种,P轨道有3种,共有4伸展方向。由于同一轨道上的两个电子自旋方向不同,故共有7种不同运动状态的电子。
(2)2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,正反应是吸热反应,如果反应的平衡常数K值变大,则生成物浓度增大,反应物浓度减小,则有 A.一定向正反应方向移动,正确。B.在平衡移动时正反应速率先增大后减小,说明平衡右移,正确。 4NH3 (g)+3O2 (g) - Q ,正反应是吸热反应,如果反应的平衡常数K值变大,则生成物浓度增大,反应物浓度减小,则有 A.一定向正反应方向移动,正确。B.在平衡移动时正反应速率先增大后减小,说明平衡右移,正确。
(3)相当于在恒容容器中,A.容器中气体的平均分子量不随时间而变化,说明达到了平衡,正确。 B.通入大量稀有气体各物质的量浓度没有改变,反应的速率不改变,错误。C.由于反应前后气体的质量不等,所以容器中气体的密度不随时间而变化可以做为平衡判断的依据,正确。D.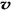 (N2)/ (N2)/ 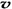 (O2)=2:3,速率之比等于化学计量数之比,正确。 (O2)=2:3,速率之比等于化学计量数之比,正确。
(4)该反应4NH4ClO4 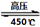 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑中,氧化产物是氮气和氧气,还原产物是氯化氢,物质的量之比是 7∶4?,每分解1mol高氯酸铵,转移的电子数目是 8NA?或 4.816×1024 个。 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑中,氧化产物是氮气和氧气,还原产物是氯化氢,物质的量之比是 7∶4?,每分解1mol高氯酸铵,转移的电子数目是 8NA?或 4.816×1024 个。
本题难度:一般
5、选择题 已知溶液中:还原性HSO3—>I—,氧化性:IO3—>I2>SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是(?)
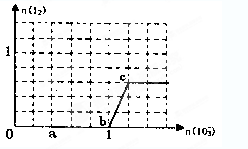
A.a点时NaHSO3过量
B.b点时还原产物为I—
C.b点到c点,KIO3与NaHSO3反应生成I2
D.加入的KIO3为0.4 mol或1.12 mol时,科_I—均为0.4 mol
参考答案:C
本题解析:根据氧化性和还原性强弱顺序可知,首先发生反应5HSO3-+2IO3-=I2+5SO42-+H2O+3H+、H2O+I2+HSO3-=2I-+SO42-+3H+,即3HSO3-+IO3-=I-+3SO42-+3H+、当溶液中HSO3-完全被反应后,又发生反应IO3-+5I-+6H+=3I2+3H2O,所以选项C是错误的,其余都是正确的,答案选C。
本题难度:一般
|  CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为? _______ 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①; 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;