1、选择题 实验室制取少量N2,常利用的反应是:NaNO2+NH4Cl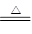 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A.NaNO2是氧化剂,发生还原反应
B.生成1mol N2时转移的电子数为6mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
参考答案:A
本题解析:A、正确;B、生成1mol N2时转移的电子数为3mol,错误;C、NH4Cl中的N元素被氧化,错误;D、N2既是氧化产物又是还原产物,错误。
本题难度:一般
2、选择题 木炭与浓硫酸反应可表示为:C +2H2SO4(浓)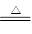 ?CO2↑+2SO2↑+2H2O。
?CO2↑+2SO2↑+2H2O。
(1)该反应的反应物和生成物中,属于氧化物的是?。
(2)木炭作?(填“氧化剂”或“还原剂”),硫酸?(填“被氧化”或“被还原”)。
(3)若消耗了2mol H2SO4,则生成?mol SO2。
参考答案:(1)CO2 、SO2、?H2O?(2)还原剂?被还原?(3)1
本题解析:氧化物是由氧和另一种元素组成的化合物,即氧化物的组成元素有两种,其中一种为氧元素。根据氧化物的定义可知该反应的反应物和生成物中,属于氧化物的是CO2 、SO2、H2O。(2)在反应中C的化合价由反应前单质中的0价变为反应后CO2中的+4价,化合价升高,失去电子,被氧化,作还原剂;H2SO4中的S的化合价一部分由反应前的+6价变为反应后SO2中的+4价,化合价降低,得到电子,被还原,作氧化剂,还有一部分未参加氧化还原反应,起酸的作用,提供酸根离子用来结合形成盐。每有2摩尔的浓H2SO4参加反应,产生1摩尔的SO2。
本题难度:一般
3、填空题 红丹(Pb3O4)是红褐色,古代是道士们炼制的仙丹主要成分之一,而现代科学发现红丹有毒,可作为防锈用涂料;请写出下列有关反应的化学方程式:
(1)红丹可用黄色粉末PbO在空气中加热制备;?
(2)红丹与浓盐酸反应生成PbCl2、Cl2和10个电子的化合物分子;?
(3)黄色粉末PbO与一定量木炭粉混合后,在加热条件下反应;①?
②?、③?、④?
参考答案:(1)6PbO + O2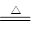 ?2Pb3O4? (2)? Pb3O4 + 8HCl ===3PbCl2 ?+ Cl2 ↑ + 4H2O
?2Pb3O4? (2)? Pb3O4 + 8HCl ===3PbCl2 ?+ Cl2 ↑ + 4H2O
(3) PbO + C 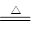 ?Pb + CO↑? 2PbO + C
?Pb + CO↑? 2PbO + C 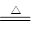 ?2Pb + CO2↑
?2Pb + CO2↑
PbO + CO 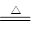 ?Pb + CO2↑? CO2? + C
?Pb + CO2↑? CO2? + C 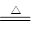 ?2CO
?2CO
本题解析:(1)PbO倍氧气氧化,即生成Pb3O4,反应式为6PbO + O2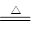 ?2Pb3O4。
?2Pb3O4。
(2)根据原子守恒可知,10电子的化合物是水分子,所以反应式为Pb3O4 + 8HCl ===3PbCl2 ?+ Cl2 ↑ + 4H2O。
(3)碳在加热的条件下能含有Pb O,其氧化产物可以是CO,也可以是CO2。产生的CO也可以含有PbO,同时CO2在加热时也和CO2反应,所以有关方程式有PbO + C 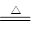 ?Pb + CO↑ 、? 2PbO + C
?Pb + CO↑ 、? 2PbO + C 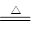 ?2Pb + CO2↑、PbO + CO
?2Pb + CO2↑、PbO + CO 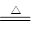 ?Pb + CO2↑、 CO2? + C
?Pb + CO2↑、 CO2? + C 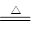 ?2CO。
?2CO。
本题难度:一般
4、填空题 配平下列各氧化还原反应方程式(将系数填写在相应横线上,并按要求填空)
⑴? ___ KMnO4 ?+ ___ HCl =" _____" MnCl2 ?+ _____ KCl ?+ ____ Cl2 ↑ ?+ ___ H2O
⑵? ____ HNO3? =? ___NO2 ↑ + _____ O2 ↑+? _____H2O
⑶?_____Na +____Cu2+ + ____H2O ==______Na+? +? ____Cu(OH)2 ↓ + ____H2 ↑?
该反应的氧化剂是?;若转移的电子数是1mol,则得到H2?mol
参考答案:(8分) (1) 2? 16? 2? 2? 5? 8? (2)4 ?4 ?1? 2 (3)? 2? 1? 2? 2 ?1? 1 ;? H2O? 0.5
本题解析:(1)根据方程式可知,高锰酸钾中Mn元素的化合价从+7价降低到+2价,得到5个电子,即氯化锰是还原产物。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,即氯气是氧化产物,所以根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是2:5,然后在根据原子守恒逐一配平即可得出正确的答案。
(2)硝酸中氮元素的化合价从+5价降低到+4价,得到1个电子,NO2是还原产物。硝酸中氧元素的化合价从-2价升高到0价,失去2个电子,则氧气是氧化产物,所以配平后的方程式应该是4HNO3=4NO2 ↑ +? O2↑+2H2O。
(3)同样根据电子得失守恒和原子守恒可知,该反应的离子方程式是2Na +Cu2+ +2H2O ==2Na++Cu(OH)2 ↓+H2 ↑。水中氢元素的化合价升高,所以反应的氧化剂是水,若转移的电子数是1mol,则得到H20.5mol。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和方法的指导与训练。该题的关键是准确判断出有关元素的化合价变化情况,然后依据电子得失守恒灵活运用即可。
本题难度:一般
5、计算题 取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。将锥形瓶置于冰水中冷却,得到橙黄色的晶体A。
将少量A置于室温下的干燥的试管中,发现A有升华现象,用湿润的KI-淀粉试纸在管口检测,试纸变蓝.接着把试管置于热水浴中,有黄绿色的气体生成,管内的固体逐渐变成红棕色液体。
将少量A分别和KI,Na2S2O3,H2S等溶液反应,均首先生成I2。
酸性的KMnO4可将A氧化,得到的反应产物是无色的溶液。
(1)写出A的化学式;写出上述制备A的配平的化学方程式。
(2)写出A受热分解的化学方程式。
(3)写出A和KI反应的化学方程式。
附:原子量 K 39.10;Cl 35.45;I 126.9;O 16.00
参考答案:(1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O
(2)ICl3=ICl+Cl2
(3)ICl3+3I-=2I2+3Cl
本题解析:M(KClO3)=122.55g·mol-1,M(I2)=253.8g·mol-1
n(KClO3)=0.0204mol,n(I2)=0.0197mol,n(KClO3)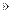 n(I2)。橙黄色的晶体A
n(I2)。橙黄色的晶体A
可以升华,A为分子晶体,A的化学式应为ICln。
生成A的反应物为:KClO3、I2、浓HCl,生成物为ICln和KCl。在ICln中I和Cl的氧化数分别为+n、-1。KClO3中Cl的氧化数降6,I2中I的氧化数升高n,根据氧化数的变化数相等,得:2n=6,n=3。A的化学式是ICl3。
(1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O
(2)ICl3=ICl+Cl2
(3)ICl3+3I-=2I2+3Cl
本题难度:一般