1、选择题 取5.06g由等物质的量的NaBr和NaI组成的混合物样品溶于水,然后通入224mL(标准状况下)Cl2 充分反应,则被氧化的Br-的物质的量是
A.0
B.0.01mol
C.0.02mol
D.0.04mol
参考答案:A
本题解析:略
本题难度:简单
2、简答题 已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.
(1)用电离方程式解释NaHC2O4溶液显酸性的原因:______;
(2)常温下,向10mL?0.01mol/L?NaHC2O4溶液中滴加10mL?0.01mol/L?NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接:______;
(3)配平以下氧化还原反应方程式:
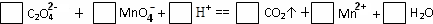
(4)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL?溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.
①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L?NaOH?溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为______mol;
②第二份溶液滴加0.10mol/L?酸性KMnO4溶液至16mL时反应完全,该溶液中还原剂的物质的量为______mol.
③原试样中H2C2O4?2H2O的物质的量为______?mol,KHC2O4的质量分数为______.
参考答案:(1)NaHC2O4溶液显酸性的原因是:HC2O4-?

?H++C2O42-,电离程度大于水解程度,
故答案为:HC2O4-?

?H++C2O42-;
(2)向10mL?0.01mol/L?NaHC2O4溶液中滴加10mL?0.01mol/L?NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,在该溶液中,直接电离出的钠离子和草酸根浓度最大,但是草酸根会水解,所以c(Na+)>c(C2O42-),草酸根水解生成草酸氢根和氢氧根,溶液显碱性,水电离会生成一部分氢氧根,所以c(OH-)>c(HC2O4-)>c(H+),
故答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2;5;6;2;10;8;
(4)①根据中和反应的实质知道氢离子的物质的量即为氢氧化钠的物质的量,即0.25mol/L×0.02L=0.005mol,
故答案为:0.005mol;
②氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,滴加0.10mol/L?酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为0.0016×52=4×10-3mol,
故答案为:4×10-3mol;
③设原样品中含有H2C2O4?2H2O的物质的量为x,含有KHC2O4的物质的量为y,则2x+y=5×10-3mol,x+y=4×10-3mol,
解得x=10-3mol,y=3×10-3mol,所以3×10-3mol×128g/mol6.0×100%=6.4%,故答案为:10-3mol;6.4%.
本题解析:
本题难度:一般
3、填空题 硫氰(SCN)2与卤素X2性质相似,试完成下列反应的化学方程式:HSCN+MnO2___________________
参考答案:4HSCN+MnO2==(SCN)2+Mn(SCN)2+2H2O
本题解析:
本题难度:一般
4、填空题 (10分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

(l)在上述有编号的步骤中,需用还原剂的是?,需用氧化剂的是?(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是?(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□?
参考答案:(1)①、④(每空2分) ?(2)Cr(OH)3(2分)
(3)1? 6? 14? 2? 2? 6? 3;7H2O(2分);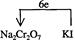 (2分)
(2分)
本题解析:(1)①中Cr的化合价由+6降低到+3,被还原,故要加入还原剂。④中Cr的化合价由+3升高到+6,故要加入氧化剂。
(2)由框图知,变化②和③中Cr的化合价没有改变,变化③是Cr(OH)3与NaOH的反应,而Cr(OH)3又可以看成是一种碱,故两性物质是Cr(OH)3
本题难度:简单
5、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
 SiO2 +
SiO2 + C+
C+ N2
N2
 Si3N4+
Si3N4+ CO
CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___________,其还原产物是___________;
(3)该反应的平衡常数表达式为K=___________;
(4)若知上述反应升高温度,其平衡常数值减小,则该反应的反应热ΔH______零(填“大于”、“小于”或“等于”);
参考答案:(1) (2)N2;Si3N4
(2)N2;Si3N4
(3)c6(CO)/c2(N2)
(4)小于
本题解析:
本题难度:一般