1、简答题 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为______.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(3)液态肼与液态双氧水反应中当有1mol氧化产物生成时转移的物质的量是______
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
参考答案:(1)反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为256.7KJ0.4=641.75kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75KJ/mol:则16g液态肼物质的量=16g32g/mol=0.5mol;与液态双氧水反应生成液态水时放出的热量408.875KJ;故答案为:408.875KJ;
(3)反应方程式为:N2H4+2H2O2=N2+4H2O,化合价升高的物质N2H4做还原剂被氧化得到氧化产物,所以氧化产物为N2,N2H4~N2~4e-;所以反应中当有1mol氧化产物生成时转移的物质的量是4mol;故答案为:4mol;
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染;故答案为:产物不会造成环境污染;
本题解析:
本题难度:一般
2、填空题 CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
|
初始投料
| 2 molH2、1 molCO
| 1 mol CH3OH
| 4 molH2、2 molCO
|
平衡时n(CH3OH )
| 0.5mol
| n2
| n3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
|
体系的压强
| P1
| P2
| P3
|
反应物的转化率
| α1
| α2
| α3
|
①该温度下此反应的平衡常数K为 。
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
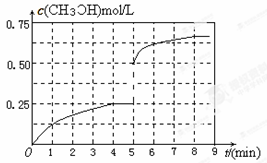
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。

(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
参考答案:(1)2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol
(2)正极:O2+4e-+2CO2=2CO32-
(3)①4;②AB;③如图:
(4)③>④>②>①;cd
本题解析:(1)利用盖斯定律,将所给反应I+反应II-反应III可得2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol。
(2)以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,该燃料电池的正极反应为O2+4e-+2CO2=2CO32-。
(3)①根据表格数据(甲组实验),利用三段式可得:
2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
起始浓度(mol/L):1 0.5 0
变化浓度(mol/L):0.5 0.25 0.25
平衡浓度(mol/L):0.5 0.25 0.25
所以平衡常数K=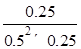 =4;
=4;
②恒温恒容条件下,实验甲和实验乙为等效平衡,甲为从正反应方向进行,乙为从逆反应方向进行,故两种情况下反应物的转化率α1+α2=1,反应放出和吸收的热量数值之和Q1+Q2=d;实验丙反应物是甲的2倍,相当于增大压强,则平衡向正反应方向移动,使反应物转化率增大,α3>α1,平衡时n3>1.0mol,P3<2P1,Q3>2Q1,故选AB。
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,压缩的瞬间,甲醇的浓度为原来的2倍,然后平衡向正反应方向移动,使甲醇浓度进一步增大,直至平衡,据此可作出CH3OH的物质的量浓度的变化曲线图像。
(4)根据题给信息可知甲酸的酸性比乙酸强,故HCOONa溶液比CH3COONa溶液水解程度小,所以四种溶液的pH由大到小的顺序为③>④>②>①;对于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液,根据物料守恒c(HCOOˉ)+c(HCOOH)=" 0.1" mo1/L;电荷守恒为c(HCOOˉ)+ c(OHˉ)=c(Na+)+c(H+),又溶液呈酸性,所以c(H+)>c(OHˉ),故c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ),将物料守恒和电荷守恒联立,可得c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+),综上,cd正确。
考点:考查盖斯定律、燃料电池电极反应式书写、化学平衡、盐类水解等相关知识。
本题难度:困难
3、选择题 25℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是
[? ]
A.C(s)+O2(g)=CO(g) △H= -396 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -896 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
D.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= +736kJ·mol-1
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列有关热化学方程式的表示及说法正确的是( )
A.已知c(石墨,s)=c(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
C.HCl和NaOH反应的中和热为-57.3kJ/mol,则H2SO4和Ba(oH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知I2(g)+H2(g)═2HI(g)△H1;I2(s)+H2(g)═2HI(g)△H2;则△H1<△H2
参考答案:D
本题解析:
本题难度:一般
5、选择题 1gH2燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式正确的是
[? ]
A.2H2(g)+O2(g)==2H2O(l) ΔH=-142.9kJ·mol-1
B.2H2(g)+O2(g)==2H2O(l) ΔH=-571.6kJ·mol-1
C.2H2+O2==2H2O ΔH=-571.6kJ·mol-1
D.H2(g)+1/2O2(g)==H2O(g) ΔH=-285.8kJ·mol-1
参考答案:B
本题解析:
本题难度:一般