|
高中化学知识点归纳《原电池原理》高频考点预测(2019年最新版)(二)
2019-05-30 02:45:46
【 大 中 小】
|
1、选择题 如图为一原电池装置,其中X、Y为两电极.对此装置的下列说法中正确的是( )
A.若两电极都是金属,则它们的活动性顺序为:X>Y
B.外电路的电流方向是:X→外电路→Y
C.若两电极分别为锌棒和石墨棒,则X为石墨
D.Y极上发生的是氧化反应
| 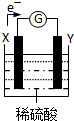
参考答案:A.由电子的流动方向可知X为原电池的负极,Y为原电池的正极,负极为较活泼金属,若两电极都是金属,则它们的活动性顺序为:X>Y,故A正确;
B.电流的方向和电子的方向相反,应为Y→外电路→X,故B错误;
C.若两电极分别为锌棒和石墨棒,则X为锌棒,为负极,故C错误;
D.Y为正极,发生还原反应,故D错误.
故选A.
本题解析:
本题难度:简单
2、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的能量转化主要形式是 __________________,在导线中电子流动方向为_________ (用a、b表示)。
(2)负极反应式为_________________ 。
(3)电极表面镀铂粉的原因为________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
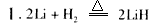
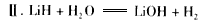 ↑ ↑
①反应I中的还原剂是__________ ,反应Ⅱ中的氧化剂是______________________。
?②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为_________________________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______________________ mol。
参考答案:(1)由化学能转变为电能;由a到b
(2)2H2 +4OH- -4e-===4H2O或H2 +2OH- - 2e- === 2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li ;H2O ②1/1148或8.71×10-4 ;③32
本题解析:
本题难度:困难
3、选择题 某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是?
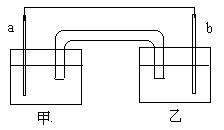 ? ?
A.b为负极,电极方程式为:Ag + + e- =" Ag"
B.甲中出现大量蓝色沉淀
C.总反应为:Cu + 2 Ag + = Cu2+ + Ag
D.反应时,盐桥中的K+向乙方向移动
参考答案:D
本题解析:略
本题难度:一般
4、选择题 用铅蓄电池电解苦卤水?(含C1-、Br-、Na+、Mg2+)的装置如图所示?(a、b为石墨电极).下列说法中正确的是( )

A.铅蓄电池放电时,Pb为正极
B.铅蓄电池充电时,A极应与外电源负极相连
C.电解苦卤水时,a?电极首先放电的是Cl-
D.当b极产生0.01mol?气体时,铅蓄电池中消耗0.01?molPbO2
参考答案:A.铅蓄电池放电时,Pb为负极,故A错误;
B.铅蓄电池充电时,A极应与外电源正极相连,故B错误;
C.电解苦卤水时,a?电极首先放电的是Br-,故C错误;
D.由b极生成氢气,则H2↑~2e-~PbO2,则b极产生0.01mol?气体时,铅蓄电池中消耗0.01?molPbO2,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
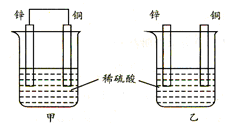
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+
C.两烧杯中的pH值均增大
D.产生的气泡速率甲比乙慢
参考答案:C
本题解析:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;B.乙中不构成原电池,铜片不是电极,故B错误;C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C正确;D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;故选C.
本题难度:一般
| 