1、填空题 (本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2?
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是?(填反应序号),理由是?。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极:?;负极:?。
参考答案:(本题共9分)
(1) ① (1分)?反应①是氧化还原反应,有电子转移。(2分,说明有电子转移给满分,只讲氧化还原反应给1分)
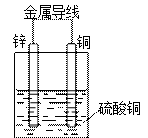 (2)
(2)
(画出图2分;标注电极全对1分,标注电解质正确1分,共4分)
②负极:Zn –2e- = Zn2+(1分)?正极:Cu2+ + 2e- =" Cu" (1分)
本题解析:略
本题难度:简单
2、选择题 下图为某原电池的结构示意图,下列说法中不正确的是
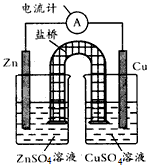
[? ]
A.原电池工作时的总反应为Zn+Cu2+==Zn2++Cu该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
参考答案:C
本题解析:
本题难度:一般
3、简答题 原电池是化学对人类的一项重大贡献.
(1)某兴趣小组为研究原电池原理,设计如图装置.
①a和b不连接时,烧杯中发生反应的离子方程式是______.
②a和b用导线连接,Cu极为原电池______极(填“正”或“负”),电极反应式是______.Zn极发生______(填“氧化”或“还原”)反应.溶液中H+移向______(填“Cu”或“Zn”)极.
③无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻______g.
(2)有同学向把Ba(OH)2?8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?______(填“是”或“否”),理由是______.

参考答案:(1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
②a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e-=H2↑;氧化;Cu;
③锌片减少的质量=0.2mol2×65g/mol=6.5g,故答案为:6.5;
(2)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热.
本题解析:
本题难度:一般
4、填空题 (8分)在以铁、铜为两电极的原电池中,如图所示:
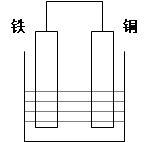
(1)若电解质溶液为稀硫酸,则铜电极上的电极反应式为: ;原电池总反应的离子方程式: ;
(2)若电解质溶液为浓硝酸, 则铁电极上的电极反应式为: ;当电路中通过了1mol的电子时,则在某极上生成了标准状况下的气体体积为: L。
参考答案:(1) 2H++2e-= H2↑;2H++Fe= Fe2++H2↑;
(2) NO3-+2H++e-= NO2↑+ H2O;22.4。
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。铁比铜活泼,铁是负极,铜是正极,溶液中的氢离子得到电子。
(2)如果是浓硝酸,由于铁会发生钝化,所以作负极的是铜,失去电子而溶解。铁是正极,溶液中的NO3-得到电子,反应式为NO3-+2H++e-= NO2↑+ H2O。根据电极反应式可知,当电路中通过了1mol的电子时,生成NO2的体积在标准状况下为22.4L。
本题难度:一般
5、选择题 “便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- =?X + 2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
参考答案:D
本题解析:A.电池内部H+由正极向正极移动,错误;B.由于是酸性电解质溶液,另一极的电极反应式为:O2 + 4e- +? 4H+= ?2H2O,错误;C.乙醇在负极发生反应,电子经过外电路流向正极,错误;D正确;
本题难度:一般