1、实验题 硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ??,表明SO2吸收效率低的实验现象是B中溶液 ??。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积 91ExaM.org的条件下,除了及时搅拌反应物外,还可采取的合理措施是 ?、??。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
序号
| 实验操作
| 预期现象
| 结论
|
①
| 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。
| _______________
| 样品含NaCl
|
②
| 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。
| _______________
| 样品含NaOH
|
?
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O? 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能?(填“无影响”、“偏低”或“偏高”),原因是?。
参考答案:(1)①品红、溴水或KMnO4溶液;溶液颜色很快褪色或指出相应试剂的正确颜色(红色、黄色等)很快褪色也可得分。?(2分,每个1分)
②增大SO2的接触面积、控制SO2的流速、适当升高温度(答其中二条即可)(4分,每个2分)
(2)(8分,每个2分)
序号
实验操作
预期现象
①
滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。
有白色沉淀生成
②
加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH
有白色沉淀生成,上层清液pH大于10.2
?
(3)6000a/214V 或3000a/107V? (其它正确答案也给分)?(2分)
(4)偏高;4I—+4H++O2=2I2+2H2O
本题解析:(1)①由于SO2具有还原性、漂白性,因此若 装置B的作用是检验装置A中SO2的吸收效率,则B中试剂可以是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色。
②要使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度等。
(2)氯离子的检验可以利用硝酸酸化的硝酸银溶液;由于饱和碳酸钙溶液的pH=10.2,所以可以先进入氯化钙溶液,然后测量溶液的pH值进行对比即可,因此答案为:
序号
实验操作
预期现象
①
滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。
有白色沉淀生成
②
加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH
有白色沉淀生成,上层清液pH大于10.2
?
(3)ag硝酸钾的物质的量是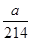 mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
1mol? 6mol
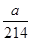 mol?
mol?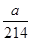 mol×6
mol×6
所以c(Na2S2O3)=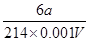 mol/L=
mol/L=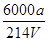 mol/L
mol/L
(4)由于碘离子易被氧化:4I—+4H++O2=2I2+2H2O,因此如果第三步滴速太慢,则导致消耗的硫代硫酸钠溶液的体积增加,从而导致其浓度偏高。
本题难度:困难
2、判断题 重庆开县的天然气矿“井喷”事故对人畜造成了极大的伤害。主要原因是喷发出的天然气中含有浓度较大的硫化氢气体,这种气体具有臭鸡蛋气味,有剧毒,其毒性原理为阻断机体细胞的内呼吸导致全身缺氧。由于中枢系统对缺氧敏感,因而首先受到损害。其爆炸极限为4.3%~45.5%,着火点为292℃。其相对分子质量为34,与空气的相对密度为1.2。
针对这次“井喷”事故,有专家提出如下现场处理措施:
(一)在井架入口、井架上、钻台边上、循环系统等处设置风向标,一旦发生紧急情况,作业人员可向1方向疏散。
(二)在含硫钻井地区的生产班当班人员每人配一套空气呼吸器2,另配一定数量的公用呼吸器,并做到人人会用、会维护、会检查。
(三)加强对钻井液中硫化氢浓度的测量,充分发挥除硫剂和除气器的功能,保持钻井液中硫化氢含量在15mg﹒m-3以下。当硫化氢含量超过20mg﹒m-3安全临界浓度3时,工作人员应佩戴空气呼吸器,不允许单独行动,派专人监护现场。
(四)钻井队在现场条件下不能实施井控作业,决定放喷时,放出天然气烧掉4。
放喷点火应派专人进行……
(1)如果你负责疏散群众,那么,受灾人员的疏散方向时
A.顺风向? B.逆风向? C.地势高的方向? D.地势低的方向
(2)空气呼吸器中可盛放的物质是
A.氢氧化钠? B.碱石灰? C.氯化钠? D.氨水
(3)检测人员从现场取出500mL,含H2S 0.01mol,则此时工作人员
A.可安全生产? B.必须佩戴空气呼吸器
C.迅速离开现场? D.无法确定
(4)①点燃天然气时应注意什么问题?
②点燃天然气实属无奈之举,因为此法并不能完全消除环境污染,为什么?
参考答案:(1)BC?(2)AB?(3)BC (4)①一要防止爆炸;二要防止中毒:人要佩戴防护用具,并站在天然气的逆风向处点火。②因为硫化氢燃烧会产生二氧化硫气体,同时,部分天然气如果不完全燃烧,还可能产生CO气体和大量烟尘,造成二次污染。。
本题解析:(1)根据硫化氢比空气密度大的特点,应该要向高处疏散;至于顺风还是逆风,应属常识,如果顺风,则永远跑不出污染区,因而应逆疏散。(2)硫化氢能与氢氧化钠或碱石灰反应而被吸收,可用;而与氯化钠不反应,不可用;虽然能和氨水反应,但氨水本身具有很强的刺激性,不可用。(3)H2S已大大超标,即使佩带空气呼吸器,也有一定危险,应迅速离开现场。(4)①一要防止爆炸;二要防止中毒:人要佩戴防护用具,并站在天然气的逆风向处点火。②因为硫化氢燃烧会产生二氧化硫气体,同时,部分天然气如果不完全燃烧,还可能产生CO气体和大量烟尘,造成二次污染。
本题难度:简单
3、选择题 下表所列举的各组事实中,存在因果关系的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、从工业生产硫酸用浓硫酸吸收分析;
B、从氯气和二氧化硫的性质分析,混合通入水溶液中反应;
C、从金属性的强弱取决于失电子的能力分析;
D、从石墨的化学性质和导电性分析.
解答:A、三氧化硫易和水反应,但在工业制硫酸中用水吸收三氧化硫易形成酸雾,阻止吸收,所以用98.3%的浓硫酸吸收三氧化硫,无因果关系,故A不选;
B、氯气与水反应生成的次氯酸有漂白作用,二氧化硫有漂白作用,但二者在水的作用下反应生成生成硫酸和盐酸,Cl2+SO2+2H2O=H2SO4+2HCl,Cl2和SO2混合后不能用于漂白纸浆,无因果关系,故B不选;
C、金属性的强弱是由失电子能力决定的,钠失电子能力强于铝,所以钠的金属性强于铝,与铝最外层电子数多无关,无因果关系,故C不选;
D、石墨具有良好的导电性,化学性质稳定一般不发生反应,可以做电解池中的电极,所以前后有因果关系,有因果关系,故D选;
故选D.
点评:本题主要考查物质的性质和用途,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.
本题难度:困难
4、实验题 (1)下图是一套实验室制取气体的装置,用于发生、干燥和收集气体。下列各组物质中能用这套装置进行实验的是_____________(填编号)。
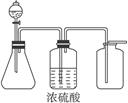
A.MnO2和浓盐酸
B.Zn和稀硫酸
C.MnO2和H2O2
D.CaCO3和盐酸
 H++
H++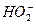 )消耗了OH-,而使酚酞褪色;乙同学认为,过氧化氢具有强氧化性,将酚酞氧化,红色消失。试设计一个简单易行的实验验证甲、乙两同学的解释哪个正确。
)消耗了OH-,而使酚酞褪色;乙同学认为,过氧化氢具有强氧化性,将酚酞氧化,红色消失。试设计一个简单易行的实验验证甲、乙两同学的解释哪个正确。