1、选择题 下列关于如图所示装置的叙述,正确的是( )
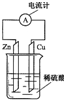
A.铜片是负极,锌片上有气泡产生
B.锌片和铜片都不断溶解,溶液逐渐变为蓝色
C.该装置可以将电能转化为化学能
D.电子从锌片流出,经导线流向铜片
参考答案:A、活泼金属锌作负极,铜作正极,负极上锌失电子,正极铜上氢离子得电子生成氢气,故A错误;
B、锌作负极,锌失电子生成锌离子进入溶液,导致锌片的质量减轻;铜片上氢离子得电子生成氢气,铜片质量不变,故B错误;
C、原电池是将化学能转换为电能的装置,故C错误;
D、电子从负极沿导线流向正极,即电子从锌片流出,经导线流向铜片,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是(?)
①锌片溶解32.5g;②锌片增重32.5g;
③铜片上析出1g H2;④铜片上析出1mol H2
A.①和③
B.①和④
C.②和③
D.②和④
参考答案:A
本题解析:由电池总反应Zn+2H+=Zn2++H2↑、正极反应2H++2e-=H2↑、负极反应Zn-2e-=Zn2+可知,每当1 mol电子通过铜片时,会有0.5 mol(即32.5 g)锌溶解,铜片上析出0.5 mol(即1 g)H2。
本题难度:简单
3、计算题 由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标状况)气体时(锌片上无气体产生),硫酸恰好反应完.计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)有多少电子通过了导线;
(3)硫酸溶液的物质的量浓度是多少.
参考答案:(1)锌? 9.75g?(2)0.3mol? (3)0.75mol/L
本题解析:略
本题难度:一般
4、选择题 关于下图所示装置的说法中,正确的是?
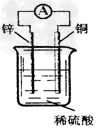
[? ]
A.铜片上发生氧化反应
B.电子由铜片通过导线流向锌片?
C.该装置能将化学能转化为电能?
D.锌片是该装置的正极,该电极反应为Zn+2e-==Zn2+
参考答案:C
本题解析:
本题难度:一般
5、选择题 在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
参考答案:原电池负极上失电子发生氧化反应,正极上得电子发生还原反应;电解池中,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,
故选C.
本题解析:
本题难度:一般