1、选择题 下列关于如图所示装置的叙述,正确的是( )
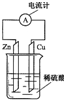
A.铜片是负极,锌片上有气泡产生
B.锌片和铜片都不断溶解,溶液逐渐变为蓝色
C.该装置可以将电能转化为化学能
D.电子从锌片流出,经导线流向铜片
2、选择题 锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是(?)
①锌片溶解32.5g;②锌片增重32.5g;
③铜片上析出1g H2;④铜片上析出1mol H2
A.①和③
B.①和④
C.②和③
D.②和④
3、计算题 由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标状况)气体时(锌片上无气体产生),硫酸恰好反应完.计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)有多少电子通过了导线;
(3)硫酸溶液的物质的量浓度是多少.
4、选择题 关于下图所示装置的说法中,正确的是?
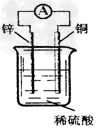
[? ]
A.铜片上发生氧化反应
B.电子由铜片通过导线流向锌片?
C.该装置能将化学能转化为电能?
D.锌片是该装置的正极,该电极反应为Zn+2e-==Zn2+
5、选择题 在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应