|
高考化学试题《原电池原理》高频考点巩固(2019年模拟版)(八)
2019-05-30 02:59:08
【 大 中 小】
|
1、选择题 下列叙述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.原电池中电流由正极流向负极,阳离子向正极移动
D.用惰性电极电解AgNO3溶液一段时间后,加入一定质量Ag粉,溶液能恢复原状
参考答案:D
本题解析:A 铜片和铁片、稀硫酸会形成原电池,铜片做正极,有氢气生成
B 正确,海轮外壳连接锌块,锌块做负极,海轮外壳做正极,不受腐蚀,采用了牺牲阳极的阴极保护法
C 正确,负极失电子,电子是从负极流向正极,电流的方向和电子相反
D 错误,用惰性电极电解AgNO3溶液,会生成银和氧气,只加入一定质量Ag粉,溶液不能恢复原状。故选D。
本题难度:一般
2、选择题 两种金属A与B组成原电池时,A是正极。下列有关推断正确的是( )
A.A的金属性强于B
B.电子不断由A电极经外电路流向B电极
C.A电极上发生的电极发应是还原反应
D.A的金属活动性一定排在氢前面
|
参考答案:C
本题解析:在原电池中,一般情况下较活泼的金属作负极,失去电子,发生氧化反应。所失去的电子经导线传递到正极上,正极得到电子,发生还原反应。A是正极,说明A的活泼性弱于B的,但A不一定排在氢前面,所以选项C是正确的,答案选C。
本题难度:一般
3、填空题 设计新型燃料电池是本世纪最富有挑战性的课题之一。
(1)有人制造了一种燃料电池,一个电极通入O2(含有少量CO2),另一个电极通入CH4,电池的电解质是熔融的K2CO3。该电池的负极反应式为____________________________,电池工作时,电解质里的CO(向________极移动(填“正”或“负”)。
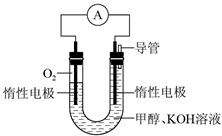
(2)某科研小组依据甲醇燃烧的反应原理,设计如图10-3所示的原电池装置。该电池的负极反应式为________________________________________________,用该电池电解CuCl2溶液,当产生33.6 L Cl2(标准状况下)时,消耗甲醇的质量为________g。
参考答案:(1)CH4+4CO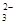 -8e-===5CO2+2H2O 负 -8e-===5CO2+2H2O 负
(2)CH3OH+8OH--6e-===CO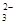 +6H2O 16 +6H2O 16
本题解析:(1)CH4在负极放电,生成CO2和H2O,电极反应式为CH4+4CO-8e-===5CO2+2H2O;熔融电解质中的阴离子向负极移动。
(2)该燃料电池的总反应方程式为:2CH3OH+3O2+4OH-===2CO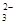 ?+6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO ?+6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO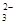 +6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)= +6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)=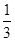 ?n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。 ?n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。
本题难度:一般
4、填空题 在课外活动中,老师请同学们利用“Fe+Cu2+=Fe2++Cu“这个反应来设计一个原电池.甲同学设置了如图所示的装置.试回答下列问题:
(1)甲同学设计的这个原电池有什么缺点?______
(2)为了克服这个缺点,请你再设计一个原电池,画出装置图(请注明所用的电极材料和电解质溶液)装置图:______.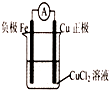
参考答案:(1)该装置理论上能构成原电池,但一般选用活泼性相差较大的两种金属,这样电势差更大,电流更明显,铜和铁的活泼性相差不很大,导致产生的电流不明显,
故答案为:电流不明显;
(2)根据电池反应式知,铁失电子,作正极,则选取不如铁活泼的且与铁活泼性相差较大的金属或导电的非金属作正极,含有铜离子的盐作电解质溶液,
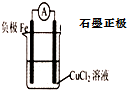
,故答案为:

.
本题解析:
本题难度:一般
5、选择题 一种碳纳米管(氢气)二次电池原理如右下图。该电池的电解质为6mol/L KOH溶液,下列说法正确的是
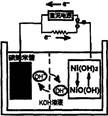
A.储存H2的碳纳米管放电时为负极,充电时为阳极
B.充电时阳极反应为NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣
C.放电时正极附近溶液的pH减小
D.放电时负极反应为H2+2OH﹣﹣2e﹣=2H2O
参考答案:D
本题解析:A.储存H2的碳纳米管放电时为负极,充电时为阴极。错误。B.充电时阳极反应为Ni(OH)2- e﹣+OH﹣=NiO(OH)+H2O。错误。C.放电时正极发生反应:NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣,c(OH﹣)增大,所以溶液的pH增大。错误。D.放电时负极反应为H2+2OH﹣﹣2e﹣=2H2O[。正确。
本题难度:简单
|