| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《键参数——键能、键长与键角》高频考点预测(2019年最新版)(四)
(4)次氟酸能被热水瞬间分解,生成一种常见的物质M,M是18e-,且被称为“绿色氧化剂”.写出次氟酸与热水反应的化学方程式:______. 参考答案:(1)因HFO为共价化合物,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氟原子形成一对共用电子对,其结构式为H-O-F,故答案为:A; 本题解析: 本题难度:一般 3、选择题 下列有关化学用语或名称,表达错误的是 参考答案:D 本题解析: 本题难度:简单 4、选择题 据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是 参考答案:A 本题解析: 本题难度:简单 5、填空题 【物质结构与性质】
解释上列碳酸盐分解温度越来越高的原因是_________________________。 (5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。 在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。 则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。  ? ?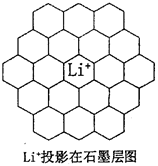 图2?图3 参考答案:(1) 本题解析:(1)碳原子有6个电子,电子排布图为 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《气体的净化.. | |