1、选择题 工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工业盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是?( ? )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式这Cl2+2e-="=" 2Cl―
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列对有关化学反应过程或实验现象的解释正确的是
[? ]
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液退色,说明BaCl2溶液有酸性?
参考答案:C
本题解析:
本题难度:简单
3、选择题 下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 ?
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
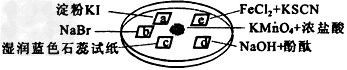
对实验现象的“解释或结论”正确的是
[? ]
实验现象?
解释或结论
A.
a处变蓝,b处变红棕色
氧化性:Cl2>Br2>I2
B.
c处先变红,后褪色
氯气与水生成了酸性物质?
C.
d处立即褪色7
氯气与水生成了漂白性物质?
D.
e处变红色
还原性:Fe2+>Cl-
参考答案:D
本题解析:
本题难度:一般
4、实验题 (7分)为了探究HClO的漂白性,某同学设计了如下的实验。

(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是?;从集气瓶B中湿润的红色布条的现象可得出的结论是?,其中发生的反应的化学方程式为?。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是?。
(3)烧杯中溶液所起的作用是?,烧杯中所发生反应的化学方程式为?。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为__________mL。
参考答案:(1)?干燥的Cl2没有漂白性,?氯水有漂白性?Cl2+ H2O="HCl+" HClO。
(2)?验证HCl是否有漂白性
(3)?吸收多余的Cl2, Cl2+2NaOH="NaCl+" NaClO+H2O 。?(4)200ml
本题解析:(1)干燥放热有色布条不褪色,说明干燥的Cl2没有漂白性。B中湿润的红色布条褪色,则说明氯水有漂白性,这是由于氯气溶于水生成次氯酸具有氧化性,反应式为Cl2+ H2O="HCl+" HClO。
(2)由于氯气和水反应,还生成氯化氢,所以还必须验证HCl是否有漂白性。
(3)氯气有毒,所以必须进行尾气处理,所以氢氧化钠是吸收多余的氯气的,方程式为Cl2+2NaOH="NaCl+" NaClO+H2O。
(4)4分钟内通过的氯气是1.12L×4=4.48L,物质的量为0.2mol,消耗氢氧化钠是0.4mol,所以氢氧化钠溶液的体积至少应是0.4mol÷2mol/L=0.2L。
本题难度:一般
5、选择题 下列关于Cl2和SO2两种气体的说法中正确的是( )
A.Cl2和SO2都是强氧化剂
B.Cl2和SO2与水反应都形成稳定的酸
C.在通常情况下,SO2比Cl2易溶于水
D.Cl2和SO2的漂白原理相同
参考答案:A.SO2中S元素化合价为+4价,处于中间价态,具有还原性,故A错误;
B.氯气与水反应生成盐酸和次氯酸,次氯酸不稳定,见光易分解,故B错误;
C.二氧化硫易溶于水,氯气微溶于水,故C正确;
D.氯气可与水反应生成具有漂白性的次氯酸,干燥的氯气不具有漂白性,二氧化硫具有漂白性,但不稳定,漂白原理不同,故D错误.
故选C.
本题解析:
本题难度:简单