1、选择题 下列有关实验可行的是()
①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2②混入KI溶液中的KHCO3可滴加盐酸除去③碘升华形成的污迹可用热的浓盐酸洗去④制Cl2后的黑褐色污迹可用热的浓盐酸洗去
A.①②
B.②③
C.③④
D.①④
参考答案:D
本题解析:KI溶液中混有KHCO3,如果滴加盐酸可除去KHCO3但同时引入杂质KCl,应加入适量氢碘酸。浓盐酸不能溶解I2,正确为加入NaOH溶液或加入乙醇。
本题难度:简单
2、选择题 在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成3种盐的一组是
[?]
A.SO2、CO2
B.C12、A12O3
C.CO2、SO3
D.SiO2、CO2
参考答案:B
本题解析:
本题难度:一般
3、实验题 某研究性学习小组欲利用已经学过的化学知识和下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。
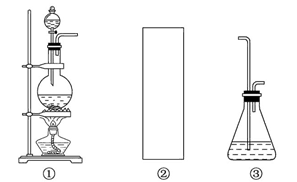
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应:3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
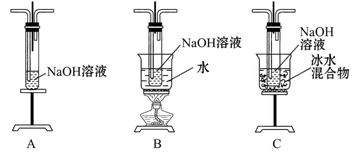
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处________。
(2)部分学生认为上述装置存在缺点,他们指出在前两个仪器之间应增加如D图所示的装置:你认为D中所盛液体是________,其作用是____________。

(3)该化学兴趣小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因________。
第二步,该化学兴趣小组的同学备选了紫色石蕊试液对次氯酸钠的性质进行实验检验。请你帮助他们完成实验报告:
?
参考答案:(1)分液漏斗? C
(2)饱和食盐水?除去Cl2中的HCl
(3)NaClO是强碱弱酸盐,水解呈碱性,ClO-+H2O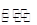 HClO+OH-
HClO+OH-
实验操作
预期现象
结论
取一干净试管,加入1~2 mL产品,然后滴加几滴紫色石蕊试液
先变蓝后褪色
次氯酸钠溶液具有碱性和氧化性(或漂白性)
本题解析:由于氯气和氢氧化钠反应是放热反应,且温度过高时,会发生副反应,所以选择装置C;由于盐酸易挥发,制得的Cl2中含有HCl杂质,所以需要加洗气装置;次氯酸钠溶液水解呈碱性;由于次氯酸钠溶液除呈碱性外还有漂白性,故加入紫色石蕊试液时先变蓝后褪色
本题难度:一般
4、填空题 硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有?性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有?性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有?性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为?(选填序号);
a.115.2 g? b.76.8 g? c.57.6 g? d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式:?。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为:?。
参考答案:(1)(3分)强氧化?不稳定?挥发
(2)(3分)d(1分)? 3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O(2分)
(3)(2分)2Cl— — 2e—=Cl2↑
本题解析:(1)由于浓硫酸具有强氧化性,在常温下能使铝发生钝化,所以常温下,可用铝槽车装运浓硫酸;浓硝酸见光易分解生成NO2、氧气和水,所以硝酸应保存在棕色试剂瓶中;由于浓盐酸易挥发,所以敞口放置的浓盐酸浓度会减小。
(2)①标准状况下13.44L气体的物质的量=13.44L÷22.4L/mol=0.6mol,根据方程式2H2SO4(浓)+Cu  CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
②由于随着反应的进行,浓硫酸的浓度逐渐降低。而铜与稀硫酸不反应,因此反应中硫酸过量。又因为在酸性条件下硝酸盐具有强氧化性,因此能氧化剩余的铜,反应的离子方程式为3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O。
(3)电解池中阳极失去电子,发生氧化反应。因此惰性电极电解饱和食盐水时阳极是氯离子放电,电极反应式为2Cl— — 2e—=Cl2↑。
本题难度:一般
5、选择题 下列说法中正确的是
A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C.铁容器可以盛放浓盐酸、浓硝酸、浓硫酸
D.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
参考答案:B
本题解析:A、在自然界中没游离态的硅,即没有单质存在的硅,故A错误;C、铁在浓硝酸、浓硫酸中钝化,与浓盐酸反应,铁容器不能盛放浓盐酸,故C错误;漂白粉、漂粉精具有强氧化性,可以用作消毒剂,D错误;故选B。
本题难度:简单