|
高中化学必备知识点《未知》试题强化练习(2019年最新版)(二)
2019-05-30 03:07:29
【 大 中 小】
|
1、填空题
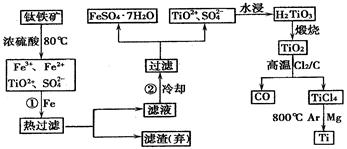
(1) Fe的原子序数为26,Fe位于元素周期表中第?周期,第?族
(2) 步骤①加铁粉的目的是?
步骤②冷却的目的是?
(3) 上述过程中,可以利用的副产物是?
(4) 写出TiO2、Cl2、C在高温下发生反应的化学方程式?
(5) 反应TiCl4+2Mg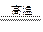 2MgCl2+Ti? ,?在Ar气体中进行的目的是? 2MgCl2+Ti? ,?在Ar气体中进行的目的是?
参考答案:

本题解析:本题以工业生产流程为背景材料的信息题,考查了化学基本理论和基础知识,题型比较新颖,属中等难度。铁粉的作用由步骤①的前后以及最后所得产物中的FeSO4·7H2O分析,不难得出是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4·7H2O可得,是为降低FeSO4·7H2O的溶解度。上述过程中,可以利用的副产物也可从反应产物入手分析为FeSO4·7H2O、CO、MgCl2。Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应。
本题难度:一般
2、填空题 (13分)近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C + K2Cr2O7+ H2SO4(稀)="=" CO2+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 。
A.酸性
B.氧化性
C.吸水性
D.脱水性
| (4)上述反应中若产生11.2 L(标准状况下)的气体物质,则转移的电子数目为 。
参考答案:(13分)(1)3C+2K2Cr2O7+8H2SO4===3CO2+2K2SO4+2Cr2(SO4)3+8H2O(3分)
(2)K2Cr2O7 CO2(各2分) (3)A (3分) (4)1.204×1024(3分)
本题解析:根据化合价升降法可配平氧化还原反应方程式,反应中C的化合价升高氧化产物为CO2,K2Cr2O7 中Cr元素化合价降低,K2Cr2O7为氧化剂;H2SO4在反应中化合价没变,只表现出了酸性;根据配平后的方程式,生成3mol气体时转移12mol电子,当生成标况下11.2 L气体时,转移电子11.2L/22.4L/mol/3×12mol=2mol,即1.204×1024个电子。
考点:氧化还原反应方程式的配平及计算
本题难度:一般
3、选择题 电视剧中所需的大量白烟是用NH4NO3和Zn粉按质量比16:13混合放于温热的石棉网上,使用时滴水数滴产生的。又知发生反应后有N2和水生成。有关的说法中正确的是①水起着溶解NH4NO3、发生吸热现象以及启动反应发生的作用;②1molNO3-在反应中得5mol e-;③成烟物质是氧化锌小颗粒;④NH4+是氧化剂
A.①②
B.②③
C.③④
D.①④
参考答案:B
本题解析:用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,换算物质的量之比=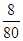 : :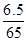 =1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B. =1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
本题难度:一般
4、选择题 已知双氧水仅发生:H2O2 O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为(?) O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消耗高锰酸钾溶液体积比为(?)
A.1:2:1:2
B.1:2:2:2
C.1:2:2:1
D.2:1:1:2
参考答案:C
本题解析:Fe2+ Fe3+ :e- ?SO32- Fe3+ :e- ?SO32- SO42- :2e-? H?2O2 SO42- :2e-? H?2O2 O2:2e-,2I- O2:2e-,2I- I2:2e-. I2:2e-.
根据电子守恒知,1mol还原剂失电子数之比等于消耗高锰酸钾的质量之比。若取2mol还原剂,消耗高锰酸钾溶液体积之比为2:4:4:2=1:2:2:1。本题易错选B,没有考虑还原剂的物质的量相等。
本题难度:一般
5、填空题 (6分) 氯气在生产生活中应用广泛。
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的化学方程式?。
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
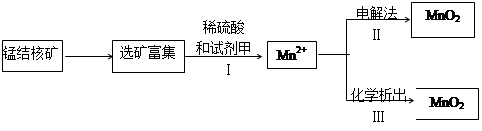
①步骤I中,试剂甲必须具有的性质是?(填序号)。
a. 氧化性?b.还原性?c.酸性?
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为________________。
参考答案:(1) 2MnSO4+Cl2+3H2O="=" Mn2O3+2H2SO4+2HCl(2分)
(2)① b(1分)?
② 2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+(3分)
本题解析:(1) 氯气与MnSO4溶液反应,氯气作为氧化剂,MnSO4被氧化为Mn2O3,方程式为:2MnSO4+Cl2+3H2O="=" Mn2O3+2H2SO4+2HCl;
(2)MnO2具有强氧化性,转化为锰离子,说明加入的物质具有还原性;当把锰离子转化为二氧化锰,生成0.050 mol MnO2,失去0.1mol电子,消耗0.020 molNaClO3,得到0.1mol电子,则1个NaClO3得到5个电子,即1个Cl降低5价,生成的应该是Cl2,反应如下:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+。
点评:根据题给信息书写氧化还原反应方程式是学生的难点,本题难度较大。
本题难度:一般
|