1、选择题 下列性质中,可以证明某化合物内一定存在离子键的是(?)。
A.水溶液能导电
B.由金属和非金属元素的原子组成
C.熔融状态能导电
D.可以溶于水并放出热量
参考答案:C
本题解析:离子键在熔融状态下,能电离出阴阳离子,即含有离子键的化合物在熔融状态下可以导电,而共价键在熔融状态下,不能电离出阴阳离子,即共价化合物在熔融状态下不能导电,据此可以鉴别,选项C正确,答案选C。
点评:该题是基础性试题的考查,侧重培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
2、填空题 在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ?mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
| 共价键 | H2分子 | N2分子 | NH3分子
键能(KJ.mo1-1)
436
945
391
|
(1)根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为______.
参考答案:(1)形成化学键放出能量,破坏化学键吸收能量;N2+3H2催化剂.高温高压2NH3,Q=生成物的键能-反应物的键能=2×3×391KJ-945KJ-
3×436>0,所以该反应是放热反应,故答案为:放热.
(2)Q1=生成物的键能-反应物的键能=2×3×391KJ-945KJ-3×436=93kJ,
故答案为:93kJ.
本题解析:
本题难度:简单
3、选择题 下列关于共价键的叙述中正确的是
[? ]
A.只有不同种元素的原子之间才能形成共价键
B.由A失去电子,B接受电子的过程形成了共价键
C.原子核外有几个电子就一定能形成几个共价键
D.共用电子对必然偏向吸引电子能力强的一方
参考答案:D
本题解析:
本题难度:简单
4、填空题 【物质结构与性质】(15分)
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
?
| X
| Y
| Z
|
I1
| 496
| 738
| 577
|
I2
| 4562
| 1451
| 1817
|
I3
| 6912
| 7733
| 2754
|
?
| 9540
| 10540
| 11578
|
①三种元素电负性大小关系为_______________
②写出Y原子的电子排布式_____________ Y的第一电离能大于Z的第一电离能的原因_______________________
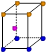
③X晶体采用下列_________(填字母)堆积方式。
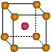 ?
?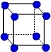 ?
?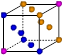 ?
?
A? B? C? D
(2)N2O的等电子体为:①分子______________,②阴离子______________;由此可知N2O的中心原子的杂化类型为_____________。根据价层电子对互斥模型确定NO2的分子构型为:_____________________________________。
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,
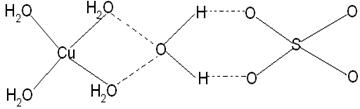
请在图中标出水合铜离子中的配位键.
参考答案:(1)①Z>Y>X?②1s22s22p63s2?;Y元素原子最外层s轨道上的电子为全满③A
(2)①CO2?②SCN-或N3-?;SP?。V型
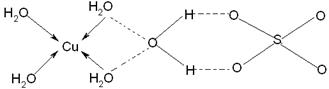
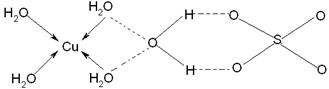
(3)
本题解析:(1)①根据元素的电离能可知X是第IA,Y是第ⅡA,Z是第ⅢA。所以金属性是X>Y>Z。金属性越强,电负性越小,所以三种元素电负性大小关系为Z>Y>X。
②Y是镁,电子排布式为1s22s22p63s2。镁元素中3s轨道是全充满状态,稳定性强。
③X是钠,采用体心立方堆积,A正确,B是简单立方堆积,C是面心立方堆积,D是六方最密堆积,答案选A。
(2)电子数和原子数分别都相等的是等电子体,所以和N2O互为等电子体的是CO2、SCN-或N3-。N2O中心氧原子含有的孤对电子是(6-3×2)÷2=0,所以氧原子是sp杂化。NO2分子中的N以两个sp2杂化轨道与氧原子成键,形成V字型的空间构型,此外分子中还形成一个三中心三电子大∏键.
(3)水合铜离子中的配位键是由水分子提供孤对电子,铜离子提供空轨道,所以结构如图所示
本题难度:一般
5、选择题 下列物质中,只含有共价键的是
A.Na2O
B.NaCl
C.HCl
D.NaOH
参考答案:C
本题解析:A错,Na2O只含有离子键;B错,.NaCl只含离子键;C正确;D错,NaOH即有离子键又有极性键;
本题难度:简单