|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2019年最新版)(八)
2019-05-30 03:17:52
【 大 中 小】
|
1、填空题 已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是______kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为______;?理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______.(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
参考答案:(1)H2的燃烧热△H分别为-285.8kJ?mol-1,分解5mol液态水消耗的能量为5mol×285.8kJ?mol-1=1429kJ,
故答案为:1429kJ;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水,正极电极反应式为:O2+4e-+4H+═2H2O,
CH3OH(l)的燃烧热△H=-726.5kJ?mol-1,故2mol甲醇完全燃烧放出的热量为2mol×726.5kJ?mol-1=1453kJ,故该燃料电池的理论效率为1162.4kJ1453kJ=80%,
故答案为:O2+4e-+4H+═2H2O;80%.
本题解析:
本题难度:一般
2、填空题 依据事实,写出下列的热化学反应方程式:
1molN2(g)与适量H2(g)起反应,生成NH3(g),放出92.2kj热量。
_____________________________________________________________________。
参考答案:N2(g) + 3H2(g) == 2NH3(g) ;△H = -92.2 KJ/mol
本题解析:
本题难度:一般
3、选择题 已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
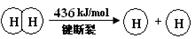
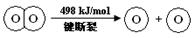
下列说法不正确的是
A.该反应原理可用于设计氢氧燃料电池
B.破坏1 mol H—O 键需要的能量是463.4 kJ
C.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
D.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
|
参考答案:D
本题解析:
试题分析:A、该反应为氧化还原反应,且是放热反应,故能设计成原电池,A正确;反应热=反应物的总键能-生成物的总键能=436x2+498-4x=-483.6,x=241.8,故B正确;2H2(g) +O2(g) = 2H2O(g),ΔH =-483.6 kJ/mol ,故逆反应吸收热量为+483.6kJ/mol,1mol水分解吸收热量为241.8 kJ/mol,C正确;键能越大越稳定,故H2(g) 中的H—H 键不如 H2O(g) 中的H—O 键牢固,D错误。答案选D
考点:反应热与原电池原理
本题难度:一般
4、选择题 心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2 则下列说法正确的是( )
A.ΔH=1/2ΔH1 -ΔH2
B.ΔH=1/2ΔH1 +ΔH2
C.ΔH=1/2ΔH1 -1/2ΔH2
D.ΔH=1/2ΔH1 +1/2ΔH2
|
参考答案:C
本题解析:锂碘电池的电池反应方程式可以由已知方程式(①-②)÷2得到,所以ΔH=1/2ΔH1 -1/2ΔH2 ,故选C。
考点:本题考查的是盖斯定律的应用计算。
本题难度:一般
5、填空题 Ⅰ(8分)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填
“高”或“低”)。
(3)物质中的化学能通过化学反应转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________
Ⅱ.同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g) ====P4O10(s) ΔH=-2 983.2 kJ·mol-1 ①
P(红磷,s)+  O2(g)="==="
O2(g)="==="  P4O10(s) ΔH=-738.5 kJ·mol-1 ②
P4O10(s) ΔH=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为____________。相同状况下,能量状态较低的是____________;白磷的稳定性比红磷____________(填“高”或“低”)。
参考答案:Ⅰ (1)放热 (2)高 (3) 热能 (4)低 (5)2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或NaOH+HCl===NaCl+H2O等合理答案均可)
ⅡP4(白磷,s)====4P(红磷,s);ΔH=-29.2 kJ· mol-1 红磷 低
本题解析:I(1)U形管中甲处液面下降乙处液面上升,说明该反应放热,温度升高,瓶内的压强增大;
(2)根据化学反应与能量的关系判断放热反应是反应物的总能量高于生成物的总能量,所以A和B的总能量比C和D的总能量高;
(3)温度升高,说明物质中的化学能通过化学反应转化成热能释放出来;
(4)反应热=反应物的总键能-生成物的总键能,该反应放热,说明反应物的总键能低于生成物的总键能;
(5)放热反应的例子有燃烧反应、活泼金属与酸的反应、中和反应等,举一例即可;
II根据盖斯定律可知,白磷转化为红磷的热化学方程式=①-4②,即P4(白磷,s)====4P(红磷,s);ΔH=(-2 983.2 kJ·mol-1)-4×(-738.5 kJ·mol-1)=-29.2 kJ· mol-1;该反应是放热反应,说明红磷的能量低于白磷,所以白磷的稳定性比红磷低。
考点:考查化学反应与能量的关系,反应热与键能的关系,物质稳定性的判断
本题难度:一般

 O2(g)="==="
O2(g)="==="  P4O10(s) ΔH=-738.5 kJ·mol-1 ②
P4O10(s) ΔH=-738.5 kJ·mol-1 ②