| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2019年最新版)(六)
(2)氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g)  2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放。某研究性学习小组用气体传感器测得不同时间NO和CO的浓度如下表:
①写出反应的化学方程式 。 ②前2 s内的平均反应速率ν(N2) = 。 参考答案:(1) ① N2(g)+O2(g)=2NO(g) △H="+183" kJ/mol (2分) > (1分) ②A、C(2分) 本题解析:(1)①由题可知,该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) △H=(945+498-2×630)kJ/mol="+183" kJ/mol;该反应在高温下为自发进行故△G=△H-T△S<0,可知该反应△S>0;②根据右图所示,只改变条件R,当N2的转化率从a3到a1时,平衡正向移动,可采取措施:升高温度平衡常数K增大,或增大氧气量,平衡常数不变,故应选AC;(2) 氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 本题难度:困难 2、选择题 下列说法或表示方法正确的是 |
参考答案:D
本题解析:A.等质量的硫蒸气的能量比硫固体的能量高,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,错误;B.石墨生成金刚石需要吸收能量,根据能量越低越稳定,石墨比金刚石稳定,错误;C.对可逆反应而言,反应物不能彻底进行,0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,反应掉的氮气小于0.5mol,所以1mol氮气完全反应放热大于38.6kJ,错误;D.中和热是指强酸、强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸在稀释过程中会放出大量的热,所以将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,正确;选D。
考点:考查化学反应中的能量变化。
本题难度:一般
3、选择题 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6kJ?mol-1
B. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)═
Ba(OH)2(aq)═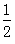 BaSO4(s)+H2O(l)△H=-57.3kJ?mol-1
BaSO4(s)+H2O(l)△H=-57.3kJ?mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4kJ?mol-1
参考答案:C
本题解析:
本题难度:简单
4、填空题 (8分) Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d64s2。
(1)Z位于元素周期表第________周期第________族,
(2)W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(3)Z基态原子的价电子排布图为______________________________________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为____________________。
(4)已知:①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1 160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
参考答案:(1)四;Ⅷ (2)小于 (3)
Fe+4H++NO3-=Fe3++NO↑+2H2O (4)173.4
本题解析:Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,则Q是氢元素。W元素原子的最外层电子数是次外层电子数的2倍,因此W的是碳元素。Y是地壳中含量最多的元素,则Y是氧元素,因此X是氮元素。Z的价电子排布式为3d64s2,则Z的原子序数是26,即为铁元素。
(1)铁位于元素周期表第四周期第Ⅷ族。
(2)非金属性越强第一电离能越大,则碳的第一电离能“小于氮的第一电离能。
(3)铁的原子序数是26,则根据核外电子排布规律可知基态原子的价电子排布图为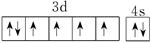 ;
;
硝酸具有强氧化性,与铁反应的的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O。
(4)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ/mol,则根据盖斯定律可知(①+②)÷2即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ/mol.4.48 L(已折算成标准状况下)CH4的物质的量是0.2mol,则还原NO2至N2的整个过程中放出的热量为867kJ/mol×0.2mol=173.4kJ。
考点:考查元素推断的有关应用
本题难度:困难
5、填空题 (10分)甲醇合成反应为:CO(g)+2H2(g)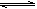 CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式 。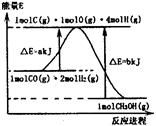
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol?L—l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
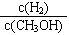 减小
减小
参考答案:(10分)
(1)CO(g)+2H2(g) CH3OH(g)?H=-(b-a)kJ/mol
CH3OH(g)?H=-(b-a)kJ/mol
(2)① 0.08 mol /(L?min) ② 25 ③ c、d
(3)① CH3OH-6e-+8OH-= CO32-+6H2O ② 2. 24 L ③ 300
本题解析:(1)根据图像可知,反应物的能量比生成物的能量高,该反应是放热反应,在根据图中数据可得合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g)?H=-(b-a)kJ/mol
CH3OH(g)?H=-(b-a)kJ/mol
(2)①根据化学反应CO(g)+2H2(g) CH3OH(g),300 ℃时反应开始10分钟内,生成甲醇0.40mol/L,则消耗氢气0.80mol/L,H2的平均反应速率为0.80/10=" 0.08" mol /(L?min);
CH3OH(g),300 ℃时反应开始10分钟内,生成甲醇0.40mol/L,则消耗氢气0.80mol/L,H2的平均反应速率为0.80/10=" 0.08" mol /(L?min);
②根据CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始 1 2 0
变化 0.80 1.6 0.80
平衡 0.20 0.4 0.80 K=0.80÷(0.20×0.40×0.40)=25
③300 ℃时,将容器的容积压缩到原来的1/2。a.压缩容器的体积,各物质的浓度均增大,c(H2)增大,错误;b.正反应速率加快,逆反应速率也加快,错误;c.增大压强,平衡正向移动,CH3OH的物质的量增加,正确;d.平衡正向移动,氢气减少,甲醇增多,重新平衡时氢气和甲醇的浓度比减小,正确;选cd。
(3)①在甲醇燃料电池中,甲醇作负极,失电子,在KOH溶液中生成碳酸钾和水,甲中负极的电极反应式为CH3OH-6e-+8OH-= CO32-+6H2O;
②工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,电极反应为
A: 4OH--4e-=O2↑+2H2O B: Cu2++2e-=Cu 2H++2e-=H2↑
4x x 0.1 0.2 2x x
4x=0.2+2x,解得x="0.1," 则乙中A极析出的气体在标准状况下的体积为2. 24 L;
③反应结束后,阳极Cu-2e-=Cu2+,阴极2Fe3++2e-=2Fe2+
0.5 0.25 0.5 0.5 0.5
加入NaOH为(0.25mol×2+0.5mol×2)÷ 5.0 mol/L=0.3L=300mL。
考点:考查热化学方程式的书写,化学反应速率及平衡常数的计算,甲醇燃料电池等知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《气体的净化.. | |