1、实验题 由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
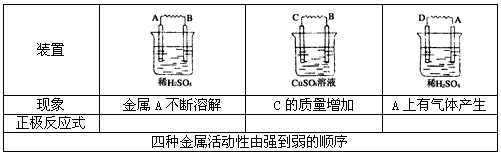
参考答案:2H++e-=H2↑;Cu-2e-=Cu2+; 2H++2e-=H2↑;D>A>B>C
本题解析:
本题难度:一般
2、填空题 运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”)?184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于?kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)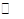 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
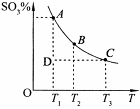
①该反应的 ?0(填“>’或“<”)。
?0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液)?。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式?。
Na2CO3水溶液呈碱性,其原因是 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=?。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=?。
参考答案:(12分)
(1)①<(2分)
②391(2分)
(2)①<(2分) ②bd(2分)
(3)①CH3OH+ 8OH--6e-= CO2- 3 + 6H2O(2分)
②CO2+2OH- = CO2- 3 +H2O(2分) 10(2分)
本题解析:
(1)①根据反应3H2(g)+N2(g)=2NH3(g) △H=-92.2kJ/mol,而向容器内放入2mol N2和6mol H2由于可逆反应不可能完全反应,所以Q<184.4 kJ。
②反应3molH2需436 kJ×3,反应1mol N2需948.5kJ,与生成2mol NH3(6mol N-H)所需能量和为-92.2kJ,1mol N—H键断裂吸收的能量等于391 kJ。
(2)①右图可知温度越高,SO3的百分含量,平衡逆向移动△H<0。
②a、恒温、恒压条件下向上述平衡体系中通入氦气容器体积变大,反应向气体分子数增多方向移动,错误。b、从D到A SO3的百分含量上升,反应正向进行,建立平衡v正>v逆,正确。c、反应放热,温度越高,K越小,K1>K2,错误。d、消耗1mol SO2必定同时消耗1mol SO3,v正=v逆,正确。
(3)①总反应:2CH3OH+3O2+4KOH=2K2CO3+6H2O;正极反应: O2+3H2O+4e-=4 OH-;两式相减可得CH3OH+ 8OH--6e-= CO2- 3 + 6H2O。
②CO2也可用NaOH溶液吸收:CO2+2OH- = CO2- 3 +H2O;
K=2×10-4mol·L-1= c(OH-)× c(HCO- 3)/c(CO2- 3)="2" c(OH-),所以c(OH-)=1×10-4mol·L-1,c(H+)=10-8,pH=10。
本题难度:困难
3、选择题 电子表所用电池的电极材料为Zn与Ag2O,电解质溶液为KOH溶液,电极反应为:Zn+2OH--2e-=Zn(OH)2;? Ag2O+H2O+2e-=2Ag+2OH-
总反应为:Zn+Ag2O+H2O=2Ag+Zn(OH)2,下列判断正确的是
A.锌为正极,氧化银为负极
B.锌发生氧化反应,氧化银发生还原反应
C.使用过程中,电流由Zn沿导线流向Ag2O
D.工作时,正极区的pH变小
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以根据电极反应式可知,锌是负极,氧化银是正极,A、C、D都是不正确的,B正确。答案选B。
本题难度:一般
4、计算题 (6分)在盛有500mL 0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:
(1)写出电极反应式:负极_______________;正极_____________________。?
(2)电极上共析出氢气的质量。
参考答案:(1)负极? Zn - 2e- = Zn2+ ?;正极 Cu2+ + 2e- =" Cu" , 2H+ +2e? = H2↑?
(2)电极上共析出氢气的质量。0.1g
本题解析:略
本题难度:简单
5、选择题 分别放置在图所示装置(都盛有0.1 mol·L-1的盐酸)中的四个相同的纯锌片,腐蚀最快是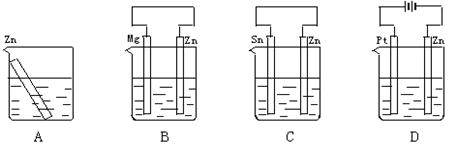
参考答案:C
本题解析:A中锌直接和盐酸发生化学反应,发生氧化反应被腐蚀。B中镁是负极,锌是正极,属于牺牲阳极的阴极保护法。C中锌是负极,锡是正极,通过原电池加速了锌的腐蚀。D中锌和电源的负极相连,作阴极,属于外加电流的阴极保护法。所以答案选C。
本题难度:一般