1、填空题 (1)某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
①若X=1,容器体积保持不变,新平衡下E的体积分数为________.
②若X=2,容器体积保持不变,新平衡下F的平衡浓度____0.5a mol/L。
(2)t℃将3mol A气体和1mol B气体通入2L固定体积的密闭容器中,发生如下反应:3A(g) + B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
①从开始反应至达到平衡状态,生成C的平均反应速率为_________,X=_____.
②若继续向原平衡混合物中通入少量氦气(不参与反应)后,化学平衡将____移动。
③若向原平衡混合物的容器中再充入a molC,在t℃达到新的平衡,此时B的物质的量为n(B)=_____________mol。
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)n(B) n(C)之间应该满足的关系为_____________________.
参考答案:(1)①50%__.
②_<5a mol/L。
(2)①速率为__0.2___,X=__4__.
②化学平衡将_不__移动。
③n(B)=____0.8+0.2a_mol。
④3:1(n≥0).
本题解析:略
本题难度:一般
2、选择题 在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:CO(g)+H2O(g) CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
[? ]
A.等于0.6mol
B.等于1mol
C.大于1mol
D.大于0.6mol,小于1mol
参考答案:D
本题解析:
本题难度:一般
3、选择题 工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
参考答案:D
本题解析:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始? 2? 1? 0
转化? 2x? x? 2x
平衡? 2-2x? 1-x? 2x
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol
所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,用SO2表示的5 min内的平均反应速率为1.8mol÷2L÷5min="0.18" mol·L—1.min—1
本题难度:一般
4、选择题 在一定温度下,反应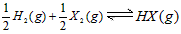 的平衡常数为9。若将1.0 mol 的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
的平衡常数为9。若将1.0 mol 的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
[? ]
A.10%
B.18%
C.20%
D.40%
参考答案:B
本题解析:
本题难度:一般
5、计算题 某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
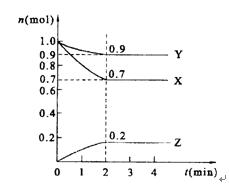
(1)反应物为?和??,生成物为?
(2)由图中所给数据进行分析,该反应的化学方程式为?;
(3)反应从开始至2min末,用Z的浓度变化表示的平均反应速率为v(Z)=?,
(4)当反应进行了3 min,该反应是否达到平衡?(填是或否)
参考答案:(1)Y? X? Z?(3分)?(2)Y + 3X?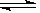 ?2Z(2分)
?2Z(2分)
(3)0.05 mol/(L·min)?(2分)(4)是(1分)
本题解析:由图可知,反应开始时,X、Y的量逐渐减小,而Z从0开始逐渐增多,但到2 min时,各物质的量不再改变,说明可逆反应此时达到了平衡状态。其中各物质的△n之比即方程式的系数比。
本题难度:一般