1、选择题 在一定温度下,反应:2A (s)+2B(g)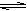 C(g)+D (g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D (g)在恒容容器中进行,不能说明该反应已经达到平衡的是
A.容器内的压强不随时间而变化
B.混和气体的密度不随时间而变化
C.A的质量不再变化
D.平衡混和气体的平均相对分子质量不再改变
参考答案:A
本题解析:可逆反应达到平衡的标志是正逆反应速率相等,各组分浓度保持不变。
2A (s)+2B(g)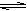 C(g)+D (g)反应前后气体体积不变,当在恒容体系中进行时,随着反应的进行体系的压强不发生变化,所以压强不变不能作为平衡判断的依据,A正确;反应物中有固体,随着反应的进行气体的质量会逐渐增大,又反应在恒容条件下进行,气体的密度会逐渐增大,某一时刻若不再发生变化说明气体的质量不再变化,各物质的浓度也将不再变化,所以B选项可以判断达到平衡;A的质量不再变化,可以推测其他物质的质量也不再发生变化,C可以作为平衡判断依据;平均相对分子质量
C(g)+D (g)反应前后气体体积不变,当在恒容体系中进行时,随着反应的进行体系的压强不发生变化,所以压强不变不能作为平衡判断的依据,A正确;反应物中有固体,随着反应的进行气体的质量会逐渐增大,又反应在恒容条件下进行,气体的密度会逐渐增大,某一时刻若不再发生变化说明气体的质量不再变化,各物质的浓度也将不再变化,所以B选项可以判断达到平衡;A的质量不再变化,可以推测其他物质的质量也不再发生变化,C可以作为平衡判断依据;平均相对分子质量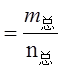 ,随着反应的进行气体的平均相对分子质量逐渐增大,当平均相对分子质量不在变化说明气体的总质量不再发生变化可以判断反应达到平衡;所以答案选A.
,随着反应的进行气体的平均相对分子质量逐渐增大,当平均相对分子质量不在变化说明气体的总质量不再发生变化可以判断反应达到平衡;所以答案选A.
本题难度:简单
2、填空题 在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
(1)达平衡时混合气体的体积为______________L,SO2的转化率为______________。
(2)若起始时加入a mol SO2、b mol O2,且a:b=2:1,在同样温度和压强下,反应达到平衡 时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
(3)若容器为体积不变的密闭容器,其容积为100L。起始时加入χmol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则χ、y应该满足的关系式为______________,χ、z应该满足的关系式为______________。
参考答案:(1)80L;(1分)?60%(1分)
(2)2.4;(2分)?1.2 (2分)
(3)χ:y=2:1;(2分)?χ+z=2(2分)
本题解析:略
本题难度:简单
3、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
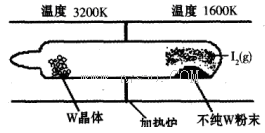
①反应(I)的平衡常数表达式K=_______,若K=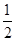 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中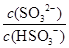 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-)
| 91:9
| 1:1
| 1:91
|
pH(25℃)
| 8.2
| 7.2
| 6.2
|
?
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
参考答案:(1)①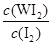 ?(2分,化学式写错不得分,漏写“c( )”其他正确只得1分)?33.3%?或33%(2分,合理答案即可)② <(2分,写“小于”不得分)? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分)
?(2分,化学式写错不得分,漏写“c( )”其他正确只得1分)?33.3%?或33%(2分,合理答案即可)② <(2分,写“小于”不得分)? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分)
(2)1.0×10-2(2分,或10-2或0.01)?减小 (2分)
(3)c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)(2分,顺序错误不得分,离子符号写错不得分,漏写“c( )”其他正确只得1分)
本题解析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的方程式W(s)+I2(g) WI2(g)可知,该反应的平衡常数表达式K=
WI2(g)可知,该反应的平衡常数表达式K=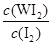 ,根据方程式可知
,根据方程式可知
W(s)+I2(g) WI2(g)
WI2(g)
起始量(mol)? 1? 0
转化量(mol)? x? x
平衡量(mol)? 1-x? x
由于反应前后体积不变,则可以用物质的量代替浓度表示平衡常数
所以K=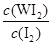 =
=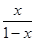 =
=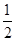
解得x=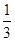
所以反应达到平衡时I2(g)的转化率为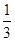 ×100%=33.3%。
×100%=33.3%。
②根据装置图可知,单质W在温度较高的情况下有利于生成,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应,即△H<0。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此判断。a.平衡时浓度不变,但物质的浓度之间不一定相等或满足某种关系,所以I2与WI2的浓度相等不能说明反应达到平衡状态,a不正确;b.W的质量不再变化,说明正逆反应速率相等,达到平衡状态,b正确;c.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此密度是变化的,所以当容器内混合气体的密度保持不变时可以说明反应达到平衡状态,c正确;d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,但二者的反应速率方向是一致的,因此不能说明反应达到平衡状态,d不正确,答案选bc。
(2)NaHSO3的水解方程式为HSO3-+H2O H2SO3+OH-,则水解平衡常数表达式=
H2SO3+OH-,则水解平衡常数表达式=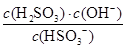 ,则
,则 =
=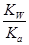 =1.0×10
=1.0×10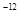 mol/L,所以该温度下H2SO3
mol/L,所以该温度下H2SO3 HSO3-+H+的电离常数Ka=
HSO3-+H+的电离常数Ka=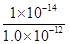 =1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中
=1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中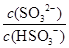 将减小。
将减小。
(3)根据表中数据可知,当n(SO32-): n ( HSO3-)=1:1时溶液显碱性,因此当溶液显中性时n(SO32-): n ( HSO3-)<1:1,所以溶液中离子浓度大小关系是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
本题难度:困难
4、选择题 在反应3H2+N2 2NH3,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为0. 45 mol/(L·s),则反应所经历的时间为?
2NH3,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为0. 45 mol/(L·s),则反应所经历的时间为?
[? ]
A.0.44 s
B.1 s
C.0.33 s
D.2 s
参考答案:D
本题解析:
本题难度:简单
5、选择题 难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列说法错误的是

A.在不同温度区域,TaI4 的量不同
B.在提纯过程中,S2 的量不断增多
C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大
D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
参考答案:B
本题解析:A、因为在不同的温度下,平衡是不一样的,因此在不同温度区域,TaI4 的量不同,正确;B、在提纯过程中,一开始S2 的量不断的增多,但是后期S2 的量不断减少,错误;[C、在一定温度下,平衡常数是定值该反应的平衡常数不随TaI4 和S2 的浓度增大而增大,正确;D、在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区,正确。
本题难度:一般