|
高中化学知识点讲解《反应速率与平衡的有关计算》答题技巧(2019年最新版)(六)
2019-05-30 03:21:27
【 大 中 小】
|
1、选择题 下图是反应A2(g)+3B2(g) 2C(g)△H<0 2C(g)△H<0
的平衡移动图,影响该反应平衡移动的原因是?
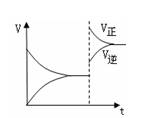 ? ?
A.升高温度
B.增大反应物浓度
C.增大压强
D.使用催化剂
参考答案:C
本题解析:略
本题难度:简单
2、填空题 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)  ?CH3OH(g) ?CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。

①该反应△H?0,△S?0(填“>”或“<”),则该反??自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是?。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K=?:
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是?(填序号)。
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时n(H2)/n(CH3OH)增大
| ③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为?,且欲使开始时该反应向逆反应方向进行,c的取值范围是?。
参考答案:(1)①<?<)?不一定?②该压强下,CO转化率已较高(90%左右),再增大压强CO转化率提高不大,且生产成本增加?(2)① 6.25?② b c?③ b = 2+2a? 1.8<c ≤2
本题解析:(1)①由图可知:在压强不变的情况下:升高温度,CO的转化率降低,说明升高温度,化学平衡向逆反应方向移动。逆反应方向是吸热反应。正反应是放热反应。所以ΔH<0.在温度不变时,增大压强,CO的转化率增大。说明增大压强化学平衡向正反应方向移动。ΔS<0..由于正反应是一个体系混乱程度减小的放热反应,所以无法确定该反应能否自发进行。②选择此压强的理由是在该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率虽然提高但提高不大,且生产成本增加的多,效益反而降低。(2)①反应开始时CO H2CH3OH的浓度分别是1mo/L? 3mol/L 0mol/L,在反应过程中转化浓度分别是0.9mol/L 1.8mol/L 0.9mol/L.所以它们的平衡浓度分别是0.1mol/L 1.2mol/L 0.9mol/L所以达到化学平衡时平衡常数是K=(0.9)÷{0.1×(1.2)2}=" 6.25" ②将容器体积压缩到原来的1/2,化学平衡向正反应方向移动。与原平衡相比,正反应速率加快,逆反应速率也加快;各物质的浓度都增大,甲醇的物质的量也增加增加 ;? D.重新平衡时n(H2)/n(CH3OH)减小。正确选项为:bc.③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为b=2+2a.假如物质时由CH3OH转化生成,则开始时n(CH3OH)=2mol,因为平衡时n(CH3OH)=0.9mol/L×2L=1.8mol.所以欲使开始时该反应向逆反应方向进行,c的取值范围是 1.8<c ≤2
本题难度:困难
3、选择题 在恒温恒容的密闭容器中,发生反应3A(g)+B(g)
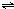
xC(g).
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a.下列说法正确的是( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B)=n(A)+3
D.若Ⅱ体系起始物质的量当满足3n(C)+8n(A)═12n(B)时,可判断x=4
参考答案:A.由于x值不确定,则若Ⅰ达平衡时,A、B、C各增加1mol,B的转化率不能确定,故A错误;
B.因容器体积不变,若x=4时,C的体积分数应为a,现大于a,x应小于4,促进平衡正向移动,故B错误;
C.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+3xn(C)=3,n(B)+1xn(C)=2,若x=2,二者联式可得3n(B)=n(A)+3,故C正确;
D.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+3xn(C)=3,n(B)+1xn(C)=2,若x=4,二者联式可得3n(C)+8n(A)═12n(B),故D正确.
故选CD.
本题解析:
本题难度:一般
4、选择题 已知:N2O4(g) 2NO2(g)?ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是 2NO2(g)?ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是
A.若再向容器内继续通入少量N2O4,则平衡向正反应方向移动
B.新平衡时,NO2的体积分数小于原平衡时NO2的体积分数
C.新平衡时,容器中气体的平均相对分子质量比原平衡大
D.新平衡时,混合气体颜色变浅,容器中气体的密度增大
参考答案:D
本题解析:若在通入N2O4,则NO2的浓度一定是增大的,所以容器内颜色变深,选项D不正确,其余选项都是正确的,答案选D。
本题难度:一般
5、选择题 将4mol A气体和2mol B气体在2L固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得C的浓度为0.6mol?L-1,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为0.3mol?L-1?s-1
B.用物质B表示的反应的平均速率为0.6mol?L-1?s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7mol?L-1
参考答案:利用三段式计算:
2A(g)+B(g)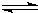 2C(g) 2C(g)
起始:2mol/L 1moL/L 0
转化:0.6mol/L 0.3mol/L0.6mol/L
2s:1.4moL/L 0.7mol/L 0.6mol/L
A.v(A)=0.6mol/L2s=0.3mol?L-1?s-1,故A正确;
B.v(B)=0.3mol/L2s=0.15mol?L-1?s-1,故B错误;
C.2s时物质A的转化率为0.62×100%=30%,故C错误;
D.以上计算可知2s时物质B的浓度为0.7mol?L-1,故D正确.
故选AD.
本题解析:
本题难度:一般
|