|
|
|
高考化学必考知识点《盐类水解的原理》试题特训(2019年最新版)(一)
2019-05-30 03:27:56
【 大 中 小】
|
1、填空题 (16分)盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是: (填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
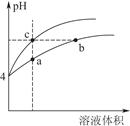
a.c(H+) b.c(OH-)
c.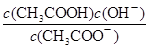 d. d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号
| 氢氧化钠溶液的浓度
(mol·L-1)
| 滴定完成时,氢氧化钠溶液滴入的体积(mL)
| 待测盐酸的体积(mL)
| 1
| 0.10
| 24.12
| 20.00
| 2
| 0.10
| 23. 88
| 20.00
| 3
| 0.10
| 24.00
| 20.00
|
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
2、选择题 酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述正确的是 ( )
A.HY-水解方程式为:HY-+ H2O H3O++ Y2- H3O++ Y2-
B.在该盐的溶液中离子浓度大小关系为:c(Na+) >c(Y2-) >c(HY-) >c(OH-) >c(H+)
C.H2Y的电离方程式为:H2Y+H2O HY-+H3O+ HY-+H3O+
D.在该盐的溶液中:c(Na+) >c(HY-) >c(Y2-)>c(OH-)>c(H+)
|
3、选择题 下列说法正确的是
A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
B.醋酸与醋酸钠的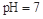 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+)
C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
|
4、选择题 常温下,0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )
A.溶液中由水电离产生的H+浓度为1×10-7 mol·L-1
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol·L-1
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
5、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断