1、选择题 有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
参考答案:C
本题解析:A、溶液①中,CH3COOH电离产生H+,H2O电离也产生H+,所以c(CH3COO-)<c(H+),错误;B、溶液①、②等体积混合,恰好反应生成的CH3COONa浓度为0.05mol?L?1,③中CH3COONa浓度为0.1mol?L?1 CH3COO?浓度不同,错误;C、溶液①、②等体积混合,恰好反应生成CH3COONa,根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=c(Na+),正确D、①、③等体积混合,溶液呈酸性,溶液中c(H+)>c(OH-),根据溶液中电荷守恒知,c(CH3COO-)>c(Na+),错误。
本题难度:一般
2、选择题 将体积都为10mL、pH都等于3的氯化铵和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积:
A.a =" b" =100mL
B.a =" b" =1000mL
C.a<b
D.a>b
参考答案:D
本题解析:氯化铵中NH4++H2O NH3.H2O+H+,加水稀释,平衡右移,C(H+)增大,当 稀释后溶液的pH均为5,氯化铵中加的水肯定多,a>b ,D正确
NH3.H2O+H+,加水稀释,平衡右移,C(H+)增大,当 稀释后溶液的pH均为5,氯化铵中加的水肯定多,a>b ,D正确
本题难度:一般
3、选择题 某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol·L-1的下列各溶液pH最大的是(?)
表:几种弱酸的电离平衡常数
酸
| 电离常数
|
CH3COOH
| Ka=1.8×10-5
|
HClO
| Ka=3.0×10-8
|
H2CO3
| Ka1=4.3×10-7,Ka2=5.6×10-11
|
H3PO4
| Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13
|
A.CH3COONa?B.NaClO?C.Na2CO3?D.Na3PO4
参考答案:D
本题解析:根据电离平衡常数可知,HPO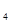
 的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D
的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D
本题难度:一般
4、填空题 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈?(填“弱酸性”、“中性”或“弱碱性”),原因是:?(用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式:?;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是?。(填编号)?
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1
B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)