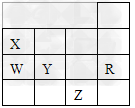
1、选择题 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是?
[? ]
A.常压下,五种元素的单质中,Z单质的沸点最高
B.W的氢化物比X的氢化物稳定性高
C.Y、Z的阴离子电子层结构都与R原子的相同
D.Y元素最高价氧化物对应水化物的酸性比W元素的最高价氧化物对应水化物的酸性强
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列氢化物中,稳定性最差的是( )
A.NH3
B.PH3
C.HF
D.H2O
参考答案:同周期元素从左到右元素的非金属性逐渐增强,则非金属性:F>O>N,同主族元素从上到下元素的非金属性逐渐减弱,则非金属性:N>P,所以有非金属性:F>O>N>P,元素的非金属性越强,对应的氢化物越稳定,P元素的非金属性最弱,则PH3稳定性最差.
故选B.
本题解析:
本题难度:一般
3、选择题 X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素,可能的组合是
[? ]
A.C、Si、Mg
B.Li、C、Mg
C.C、Mg、Li
D.C、O、Mg
参考答案:A
本题解析:
本题难度:一般
4、选择题 在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是 (?)
①AlCl3;②NaHCO3 ;③NaAlO2;④MgSO4 ;⑤Na2SO3 ;⑥KMnO4;⑦Fe2(SO4)3;⑧FeCl2
A.①②⑤
B.⑥⑦⑧
C.③④⑦
D.④⑤⑥
参考答案:C
本题解析:①AlCl3是强酸弱碱盐,加热发生水解反应产生氢氧化铝和氯化氢,氯化氢有挥发性,所以随着不断加热水分的蒸发,氯化氢气体也不断逸出,蒸干得到的固体是Al(OH)3. 灼烧发生反应2Al(OH)3 Al2O3+3H2O.故蒸干并灼烧得到的固体是Al2O3。②发生反应2NaHCO3
Al2O3+3H2O.故蒸干并灼烧得到的固体是Al2O3。②发生反应2NaHCO3 Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3。③NaAlO2是强碱弱酸盐,水解产生氢氧化钠和氢氧化铝,由于氢氧化钠没有挥发性,随着反应的不断进行,水分的不断蒸发,氢氧化钠和氢氧化铝又重新反应产生NaAlO2和水。所以最后得到NaAlO2固体。④MgSO4是不挥发性的强酸与弱碱反应生成的盐,水解产生的酸碱会重新生成MgSO4和水。最后得到的固体是MgSO4。⑤Na2SO3是还原性的弱酸H2SO3与强碱NaOH反应生成的盐。在加热的过程中水解产生的H2SO3会被氧化成H2SO4,H2SO4和NaOH反应生成难挥发的强酸强碱盐Na2SO4和水。所以最后的固体是Na2SO4。⑥KMnO4是强酸强碱盐,在溶液中不发生水解反应,但在蒸干后加热会发生分解反应:2KMnO4
Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3。③NaAlO2是强碱弱酸盐,水解产生氢氧化钠和氢氧化铝,由于氢氧化钠没有挥发性,随着反应的不断进行,水分的不断蒸发,氢氧化钠和氢氧化铝又重新反应产生NaAlO2和水。所以最后得到NaAlO2固体。④MgSO4是不挥发性的强酸与弱碱反应生成的盐,水解产生的酸碱会重新生成MgSO4和水。最后得到的固体是MgSO4。⑤Na2SO3是还原性的弱酸H2SO3与强碱NaOH反应生成的盐。在加热的过程中水解产生的H2SO3会被氧化成H2SO4,H2SO4和NaOH反应生成难挥发的强酸强碱盐Na2SO4和水。所以最后的固体是Na2SO4。⑥KMnO4是强酸强碱盐,在溶液中不发生水解反应,但在蒸干后加热会发生分解反应:2KMnO4 K2MnO4+MnO2+O2↑.所以最后得到固体是K2MnO4和MnO2的混合物。⑦Fe2(SO4)3是难挥发的强酸H2SO4和弱碱Fe(OH)3反应产生的盐。在溶液中水解得到H2SO4和Fe(OH)3。由于H2SO4无挥发性,所以二者会在加热的过程中重新反应产生Fe2(SO4)3和水。最后随着水分的蒸干而得到Fe2(SO4)3,灼烧不会发生分解反应。因此加热蒸干并灼烧得到的固体产物是Fe2(SO4)3。⑧FeCl2是挥发性的强酸与弱碱Fe(OH)2反应生成的盐。水解产生的HCl会不断挥发逸出,产生的Fe(OH)2会被空气中的氧气氧化形成Fe(OH)3.所以蒸干得到的固体是Fe(OH)3。灼烧时发生分解反应:2Fe(OH)3
K2MnO4+MnO2+O2↑.所以最后得到固体是K2MnO4和MnO2的混合物。⑦Fe2(SO4)3是难挥发的强酸H2SO4和弱碱Fe(OH)3反应产生的盐。在溶液中水解得到H2SO4和Fe(OH)3。由于H2SO4无挥发性,所以二者会在加热的过程中重新反应产生Fe2(SO4)3和水。最后随着水分的蒸干而得到Fe2(SO4)3,灼烧不会发生分解反应。因此加热蒸干并灼烧得到的固体产物是Fe2(SO4)3。⑧FeCl2是挥发性的强酸与弱碱Fe(OH)2反应生成的盐。水解产生的HCl会不断挥发逸出,产生的Fe(OH)2会被空气中的氧气氧化形成Fe(OH)3.所以蒸干得到的固体是Fe(OH)3。灼烧时发生分解反应:2Fe(OH)3 Fe2O3+3H2O.因此在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是③④⑦。
Fe2O3+3H2O.因此在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是③④⑦。
本题难度:一般
5、推断题 六种短周期元素aA、bB、cC、dD、eE、fF,已知原子序数大小关系是: ,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三元素形成的六原子核的化合物和水反应的离子方程式是:________________。
(2)A、C形成的四原子核化合物甲的电子式为______________,该化合物呈弱酸性,试写出这种化合物的电离方程式:___________________________。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:______________________________。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液相互反应的化学方程式:__________________________________。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式:__________________。
(6)A、E形成的四原子核化合物丙容易液化,其原因是:_______________________________。
参考答案:(1)SO32-+H2O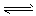 HSO3-+OH-
HSO3-+OH-
(2)双氧水电子式;H2O2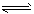 HO2-+H+
HO2-+H+
(3)H++HSO3-=SO2↑+H2O
(4)H2O2+H2SO3=H2SO4+H2O
(5)Mg3N2+6H2O=2NH3↑+3Mg(OH)2
(6)分之间形成氢键,增加了分之间作用力,使之易液化。
本题解析:
本题难度:一般