1、填空题 (NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈?色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是?。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
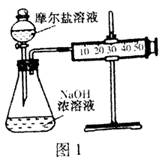
从上图推断甲同学想通过测定?计算摩尔盐的纯度。该方案的不足之处在于?。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
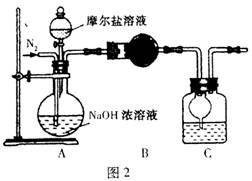
则B与C中的试剂分别是?和?。C中干燥管的作用是?。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为?%(答案精确到小数点后第一位)。
参考答案:
(1)浅绿 (2分)
(2)硫酸亚铁(2分)
(3)生成氨气的体积 (2分)
氨气有一部分会溶解在溶液中(或其它合理解释)(2分)
(4)碱石灰 (2分)?稀硫酸(2分)?防止倒吸(2分)? 78.4(2分)
本题解析:(1)摩尔盐(NH4)2Fe(SO4)2·6H2O铁的化合价为+2价,水溶液为浅绿色;(2)水溶液中亚铁离子水解,但摩尔盐中铵根离子水解抑制亚铁离子水解,相同浓度的盐溶液其亚铁离子浓度高,反过来c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是硫酸亚铁;(3)摩尔盐中铵根离子与强碱反应生成氨气,实验测定氨气的体积计算摩尔盐的浓度,氨气易溶于水,使产生的氨气不能完全逸出;(4)该实验是通过测定生成氨气的质量测定摩尔盐的纯度,故应先除掉氨气中的水蒸气,再用酸溶液吸收;因为氨气极易溶解于水会产生倒吸,故用球形干燥管防止;
n((NH4)2Fe(SO4)2·6H2O)="1/2" n(NH3)=0.68÷17÷2=0.02mol
m((NH4)2Fe(SO4)2·6H2O)= 0.02×392=7.84g
纯度为7.84÷10.0=0.784
本题难度:一般
2、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
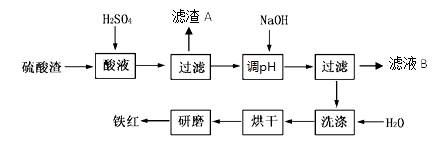
(1)硫酸渣的成分中属于两性氧化物的是?,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式?;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是?(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
|
?
(3)滤渣A的主要成分为?,滤液B可以回收的物质有____________;
(4)简述洗涤过程的实验操作?;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为?(用最简分数表达式表示)。
参考答案:(1)Al2O3? Fe2O3 + 6H+ ==2Fe3+ + 3H2O
(2)3.2—3.8
(3)SiO2? Na2SO4? Al2(SO4)3? MgSO4
(4)沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)14m/15w
本题解析:(1)Al2O3为两性氧化物,硫酸渣的成分中属于两性氧化物的是Al2O3;Fe2O3与硫酸反应生成Fe2(SO4)3和H2O,离子方程式是Fe2O3+6H+=2Fe3++3H2O;
(2)由题所给的数据可以看出,要使Fe3+完全沉淀而其它离子不能沉淀,其pH范围是3.2-3.8;
(3)硫酸渣中SiO2不与硫酸反应,所以滤渣A的主要成分是SiO2;加入NaOH调节pH后,Fe3+转化为Fe(OH)3沉淀,其它离子仍为硫酸盐,所以滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4。
(4)利用蒸馏水洗涤的方法是,沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)m kg铁红含铁元素的质量为112m/160,所以硫酸渣中铁元素质量分数为
14m/15w。
本题难度:一般
3、填空题 (4分)用下面方法可以制得白色的Fe(OH)2沉淀 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?;
(2)除去蒸馏水中溶解的氧 气常采用?的方法;
气常采用?的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是?。
参考答案:(1)铁粉?(2)煮沸?(3)防止与空气中的氧气接触
本题解析:略
本题难度:一般
4、填空题 实验室为了防止FeCl2溶液变质,通常向该溶液的试剂瓶中加入适量的?粉,取适量FeCl2溶液于试管中,滴入适量的NaOH溶液产生?色絮状沉淀,继而迅速的变为?色,最后变为?色的?(写化学式)沉淀。
参考答案:铁(Fe),白,灰绿,红褐,Fe(OH)3
本题解析:由于FeCl2易被空气中的氧气氧化为FeC3,通常向该溶液的试剂瓶中加入适量的铁粉:2FeCl3+Fe=3FeCl2
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2为白色絮状沉淀,但可被迅速氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3,变为灰绿色,最终为红褪色
本题难度:一般
5、填空题 人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质。
(1)医疗上常用_____________(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是?;
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:____________________、 ? ___________________________;
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和?,用?可以鉴别(填化学专用名词)。
参考答案:⑴FeSO4(1分); 防止亚铁离子被氧化 (1分)?;
⑵ Al(OH)3+3H+==Al3++3H2O (2分) 、? HCO3- +H+="==" H2 O + CO2↑(2分);
(3)胶体?丁达尔效应(每空1分)
本题解析:略
本题难度:一般