1、选择题 已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是
A.n=m+16
B.n=m+6
C.n=m+30
D.n=m+31
参考答案:D
本题解析:
分析:根据周期表的结构及每一周期元素的数目.
解:周期表中第一、二、三、四、五、六、七周期元素的种数分别为2、8、8、18、18、32、26,若元素在二、三周期,则原子序数n=m+6,若元素在四、五周期,由于副族和ⅥⅡ族出现在ⅠA和ⅦA族之间共10种元素,则原子序数n=m+6+10=m+16,若元素在第六周期,又多了镧系的出现,有15种元素,则原子序数n=m+16+14=m+30.
故选:D.
本题难度:简单
2、选择题 X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.1mol·L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第IVA族
C.与氢气化合时,Z比Y容易
D.甲中只含有离子键
参考答案:C
本题解析:由0.1mol·L-1甲溶液的pH为13(25℃),可以推知甲为一元强碱,可能为NaOH;Y为C。故X、Y、Z、W依次为H、C、O、Na。故答案C正确。
本题难度:一般
3、选择题 硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为(?)
A.1∶4
B.1∶2
C.1∶1
D.1∶3
参考答案:A
本题解析:假设10B与11B的物质的量之比为x:y.则硼元素的相对原子质量为(10x+11y) ÷(x+y)=10.8整理可得x:y=1:4.因此正确选项为A。
本题难度:一般
4、选择题 有Wn+、Xm+、Ym-、Zn-四种离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是
A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
参考答案:D
本题解析:略
本题难度:一般
5、填空题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是?(填名称) ,W在周期表中的位置?。
(2)X与Y 形成化合物的电子式为?,X与W组成的化合物中存在?键(填“离子”“共价”)。
(3)①写出实验室制备 91eXAm.orgYX3的化学方程式:?。
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2molYX3气体时放出
92.4kJ的热量,写出该反应的热化学方程式?。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是?。
参考答案:(1)H?第三周期第ⅥA族
(2)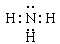 ?共价
?共价
(3)①2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O
②N2(g)+3H2(g) 2NH3(g)?△H=-92.4KJ/mol
2NH3(g)?△H=-92.4KJ/mol
(4)硫酸铵或亚硫酸铵
本题解析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素。
(1)由上述分析可知,X元素是H元素,W是硫元素,位于元素周期表的第三周期第ⅥA族,故答案为:H;第三周期第ⅥA族。
(2)X与Y 形成的化合物是氨气,含有极性键的共价化合物,电子式为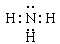 。X与W组成的化合物是H2S,分子中H、S之间以共用电子对形成化合物,则以共价键结合,故答案为:共价;
。X与W组成的化合物是H2S,分子中H、S之间以共用电子对形成化合物,则以共价键结合,故答案为:共价;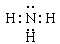 。
。
(3)①实验室制备氨气是用熟石灰和氯化铵加热,反应的化学方程式为2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O。
CaCl2 + 2NH3↑+ 2H2O。
②每生成2mol氨气气体时放出92.4kJ的热量,则该反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)?△H=-92.4KJ/mol。
2NH3(g)?△H=-92.4KJ/mol。
(4)X、Y、Z、W四种元素组成的一种离子化合物中的阳离子为NH4+,阴离子为硫酸根离子、硫酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,但1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体,则1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵。
本题难度:一般