1、选择题 在1~18号元素中有三种元素X、Y、Z,已知最高价含氧酸的酸性存在如下关系:
HXO4>H2YO4>H3ZO4,则Z元素的原子序数可能是(?)
A.16
B.9
C.15
D.7
参考答案:C
本题解析:
由从最高价氧化物的水化物的酸性强弱可知三种元素的非金属性强弱顺序为X>Y>Z,则这三种元素在周期表中的排列顺序为 Z Y X ,则原子序数:Z<Y<X。根据HXO4、H2YO4、H3ZO4 可知X、Y、Z的最外电子层上电子数分别为:7、 6、5,故Z元素有可能是磷,其原子序数为15,选C。
本题难度:简单
2、填空题 现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
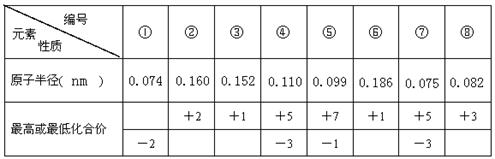
回答下列问题:
(1)①在元素周期表中的位置是(周期、族)?;
(2)比较④和⑦的氢化物的稳定性(用化学式表示)?。
参考答案:(4分)(1)第二周期第Ⅵ A族;(2分)(2)NH3>PH3(2分)
本题解析:电子层越多,半径越大,同周期从左向右原子半径在减小,最高正价在增大,最高正价等于族序数,由短周期元素的数据可知,①为O,②为Mg,③为Li,④为P,⑤为Cl,⑥为Na,⑦为N,⑧为B,
(1)①为O,在元素周期表中的位置是第二周期第Ⅵ A族。
(2)④⑦同主族,④的原子半径大,则原子序数大,④和⑦的氢化物的稳定性是NH3>PH3。考点:
点评:本题考查原子结构与元素周期律,熟悉原子半径、化合价的变化规律是解答本题的关键,题目难度不大,⑧为学生解答的易错点。
本题难度:一般
3、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/10-12 m
| 160
| 110
| 70
| 66
|
主要化合价
| +2
| +5、+3、-3
| +5、+3、-3
| -2
|
?
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
参考答案:D
本题解析:从化合价判定X是ⅡA族元素,Y、Z是ⅤA族元素,W是氧元素,再结合原子半径:X是Mg,Y是P,Z是N。O2-与Mg2+核外电子排布相同,Mg2+核电荷数大,半径小,A错;非金属性O>N,稳定性H2O>NH3,B选项错;化合物Mg3N2中只存在离子键,C选项错;酸性HNO3>H3PO4,D选项正确。
本题难度:简单
4、选择题 下列排列顺序正确的是:
①热稳定性:H2O>HF>H2S?②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4?④非金属性:S>O>F
⑤碱性:NaOH>Mg(OH)2>Al(OH)3
A.①③
B.②⑤
C.①④
D.②③
参考答案:B
本题解析:非金属性越强,氢化物越稳定,氟的非金属性强于氧的,①不正确。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,所以②⑤正确,③④不正确。答案选B。
本题难度:一般
5、填空题 (12分)按要求填空
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意 图是?,第一电离能最小的元素的原子轨道表达式_______________________。
图是?,第一电离能最小的元素的原子轨道表达式_______________________。
(2)第四周期元素中,4p轨道半充满的元素是_____________(填元素符号)
价电子层中s电子数与d电子数相同的元素是?(填元素名称)。
(3)中国古代四大发明之一――黑火药,它的爆炸反应方程式为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为_____。
②写出K的基态电子排布式_____________________ _________________
_________________
参考答案:(12分)
(1) 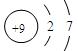 (2分)?(2分)
(2分)?(2分)
(2)? As?(2分)?钛?(2分)
(3) ① H2O>NH3>CH4?(2分)?②? 1S22S22P63S23P64S1?(2分)
本题解析:略
本题难度:一般