1、简答题 (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:?
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为?。在实验室中,FeCl2可用铁粉和?盐酸反应制备,FeCl3可用铁粉和?反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为?
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为?
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为?,该电池总反应的离子方程式为?。
参考答案:(1)3 (2)10% (0.10也可以) 盐酸?氯气
(3)2Fe3++2I-=2Fe2++I2或2Fe3++3I-=2Fe2++I3-

本题解析:

(4)根据题意,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,根据元素守恒、电子转移守恒,可得反应的离子方程式。根据原电池反应原理,锌做负极材料,失电子,发生氧化反应;K2FeO4在电池中作为正极材料,得电子,发生还原反应。
【考点定位】铁及其化合物、酸碱中和滴定、离子方程式的书写、电化学、化学计算。
本题难度:一般
2、选择题 铁有多种价态,将14.4 g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2 g铁的氧化物,则该铁的氧化物是(?)
A.Fe3O4
B.Fe2O3
C.FeO
D.FeO和Fe3O4
参考答案:C
本题解析:方法一:因隔绝空气,FeC2O4中的C、O两种元素在这种条件下不具有氧化性,铁的价态不会改变,仍是+2价,即FeO。
FeC2O4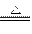 FeO+CO↑+CO2↑
FeO+CO↑+CO2↑
方法二:FeC2O4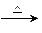 FexOy
FexOy
144? M
14.4 g? 7.2 g
M=72,即铁的氧化物的化学式为FeO。
方法三:质量守恒(铁元素),由题意推得在所得铁的氧化物中,m(Fe)="14.4" g×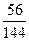 ="5.6" g
="5.6" g
m(O)="7.2" g-5.6 g="1.6" g
所以n(Fe)∶n(O)=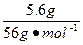 ∶
∶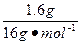 =1∶1
=1∶1
故该氧化物的化学式为FeO。
本题难度:简单
3、选择题 要鉴定某溶液中所含的一种阳离子为Fe2+(且未被氧化),最好的方法是
A.加人NaOH溶液
B.先加入KSCN溶液再加氯水
C.先加氯水再加KSCN溶液
D.加入锌片
参考答案:B
本题解析:先加入KSCN溶液显红色证明有Fe3+,,再加氯水显红色证明有Fe2+转换为Fe3+
本题难度:简单
4、实验题 现要测定某氯化亚铁和氯化铁混合物中铁元素的质量分数,按以下步骤进行实验:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。?
(2)请写出加入溴水发生的离子反应方程式:? 。?
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是 ?。?
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。?
Ⅱ.有同学提出,还可以采用以下方法来测定:
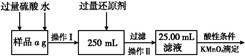
(1)溶解样品改用了硫酸,而不再用盐酸,为什么?? 。?
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是: ? 。?
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是 。?
参考答案:Ⅰ.(1)250 mL容量瓶(2分) 胶头滴管(2分)
(2)2Fe2++Br2 2Fe3++2Br-(2分)
2Fe3++2Br-(2分)
(3)再次加热并冷却至室温称量,直至两次质量差小于0.1 g(2分) 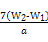 ×100%(1分)
×100%(1分)
Ⅱ.(1)过量的盐酸对后面KMnO4的滴定有干扰(2分)
(2)否(1分) 如果用铁作还原剂,自身的氧化产物是Fe2+,且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分)
(3) ×100%(1分)
×100%(1分)
本题解析:Ⅰ.(1)根据流程图,操作Ⅰ是配制一定物质的量浓度的溶液,因此另外的玻璃仪器为250 mL容量瓶和胶头滴管。(2)加入溴水将Fe2+氧化。(3)b1-b2="0.3" g,说明误差大,因此需再次加热并冷却至室温称量,直至两次质量差小于0.1 g,氧化铁的质量为(W2-W1)g,则原样品中铁元素的质量为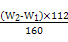 ×
× ?g=7(W2-W1) g,其质量分数为
?g=7(W2-W1) g,其质量分数为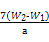 ×100%。
×100%。
Ⅱ.该方法的原理是用还原剂将Fe3+还原为Fe2+,然后用KMnO4溶液滴定,若用盐酸,则过量的盐酸被KMnO4氧化,使铁元素的质量分数偏大;不能用铁作还原剂,否则使铁元素的质量分数偏大。5F ~Mn
~Mn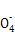 ,则原样品中n(Fe)=n(Fe2+)=5×bc×10-3×
,则原样品中n(Fe)=n(Fe2+)=5×bc×10-3× ?mol="0.05bc" mol,则m(Fe)="0.05bc×56" g="2.8bc" g,其质量分数为
?mol="0.05bc" mol,则m(Fe)="0.05bc×56" g="2.8bc" g,其质量分数为 ×100%。
×100%。
本题难度:一般
5、填空题 (10分)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO===3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是_ _______(填字母)。
_______(填字母)。
选项
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
|
A
| 铁是地壳中含量最高的
金属元素
| 铁是人类最早使用的金属材料
| Ⅰ对;Ⅱ对;有
|
B
| 常温下铁与稀硫酸反应
生成氢气
| 高温下氢气能还原氧化
铁得到铁
| Ⅰ对;Ⅱ对;无
|
C
| 铁属于过渡元素
| 铁和铁的某些化合物可用作催化剂
| Ⅰ错;Ⅱ对;无
|
D
| 在空气中铁的表面能形
成致密的氧化膜
| 铁不能与氧气反应
| Ⅰ对;Ⅱ对;有
参考答案:
本题解析:略
本题难度:一般
|