1、选择题 Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有
A.Cu、Fe3+
B.Fe2+、Fe3+
C.Cu、Cu2+、Fe
D.Cu、Fe2+、Fe
2、选择题 已知某硫酸、硫酸亚铁、硫酸铁混合溶液100 mL中,阳离子浓度均相等,硫酸根离子总浓度为6 mol·L-1,此溶液中还可以溶解铁粉的质量是
A.11.2 g
B.16.8 g
C.33.6 g
D.5.6 g
3、填空题 胆矾(CuSO4·5H2O)是一种蓝色晶体,用它进行以下几个实验:①取少量胆矾晶体,用研钵研碎后,放入硬质玻璃管中,加热,可以看到固体颜色逐渐变成白色,同时试管口有水珠生成;②冷却后,取试管内白色粉末少许,用蒸馏水溶解后得到蓝色溶液,将此溶液分置于两支试管中;③向第一支试管中滴入NaOH溶液后,可观察到有蓝色沉淀生成;④将一枚洁净的铁钉放入第二支试管中,过一会,取出铁钉,观察到铁钉表面附着一层红色物质。用化学方程式表示上述变化,并指出所发生的反应的类型。
⑴加热胆矾晶体:?,(?);
⑵生成蓝色沉淀:?,(?);
⑶生成红色物质:?,(?)。
4、填空题 (16分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物(左)和“引火铁”(右)。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热 设备等在图中均已略去)。
设备等在图中均已略去)。
填写下列空白:
⑴实验进行时试管A中应加入的试剂是______;
烧瓶B的作用是____________________;
在试管D中收集得到的是_______________。
⑵实验时,U型管G中应加入的试剂是____________;
长颈漏斗H中应加入___________。
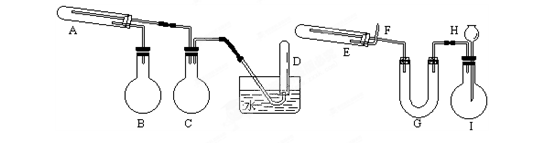 ⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑷试管E中发生反应的化学方程式是_______________。
⑸为了安全,在E管中的反应发生前,在F 出口处必须_____________________。
出口处必须_____________________。
5、填空题 铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
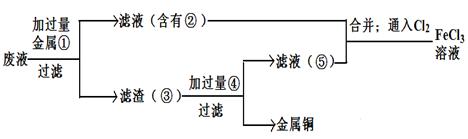
请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________