1、选择题 为了检验某FeCl2溶液是否变质,可向溶液中加入(? )
A.NaOH溶液
B.铁片
C.KSCN溶液
D.石蕊溶液
参考答案:C
本题解析:氯化亚铁极易被氧化,生成氯化铁。而铁离子能和KSCN溶液发生显色反应,溶液显红色,所以为了检验某FeCl2溶液是否变质,可向溶液中加入KSCN溶液,答案选C。
点评:该题是高考中的常见考点之一,属于中等难度的试题。试题注重基础和能力的双向考查,灵活性强,有助于培养学生严谨的逻辑思维能力,提高学生分析问题、解决问题的能力。
本题难度:简单
2、选择题 为了实现我国政府在1997年12月31日前对淮河流域环境的治理,某甲、乙两相邻的工厂做了横向联合.已知两厂排放的污水经初步处理后,只溶有Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是?(?)
A.SO42- 和NO3-可存在于同一工厂
B.Cl-和NO3-一定在不同的工厂
C.Ag+和Na+可能在同一工
D.Na+和NO3-来自同一工厂
参考答案:B
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的;Ag+和Cl-、SO42-、OH-均不能大量共存,所以Ag+和NO3-在同一种溶液中,则Cl-、SO42-、OH-在另一份溶液中。根据溶液的电中性可知,该溶液中一定含有钠离子。所以甲、乙两厂排放的污水中含有的离子分别是l-、SO42-、OH-、Na+和Ag+、Ba2+、Fe3+、NO3-,所以选项B是正确的,答案选B。
本题难度:简单
3、选择题 下列各组离子一定能大量共存的是?(?)
A.加入铝粉有氢气产生的 溶液中Na+、K+、SO42-、Cl-
溶液中Na+、K+、SO42-、Cl-
B.含有大量硝酸根离子的溶液中H+、Fe2+、SS42-、Cl-
C.c(H+)/c(OH-)=l×l0-10的溶液中NH4+、K+、Ca2+、Cl-
D.水电离的c(H+)=l×10-12mol/L的溶液中Na+、K+、HCO3- 、Cl-
、Cl-
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列说法正确的是
A.NaHCO3和Na2CO3混合溶液中,一定有
c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO32-)
B.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为
NaOH>Na2CO3>NaHSO4>(NH4)2SO4
C.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1∶2
参考答案:D
本题解析:A、不正确,电荷守恒应为:c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-);B、不正确,NaOH是强电解质,完全电离,c(OH- )=0.1mol·L-1,所以pH=13,Na2CO3是强碱弱酸盐,水溶液都呈碱性,pH小于13,(NH4)2SO4是强酸弱碱盐,水解后溶液呈酸性,1<pH值<7,NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H+)=0.1mol·L-1,所以pH=1,所以pH由大到小排列顺序为NaOH>Na2CO3>(NH4)2SO4>NaHSO4;C、不正确,在冰醋酸中逐滴加水,醋酸先溶解并电离,电离程度逐渐增大,离子浓度先增大,到后期,将冰醋酸稀释,离子浓度减小,则溶液的导电性将减小,电离程度随溶液的稀释,越来越大,溶液的pH先增大后减小;D、正确,?pH=3的H2SO4,c(H+ )=0.001mol/L,c(SO42― )=0.0005mol/L,C(CH3COO―)=0.001mol/L,c(SO42-)与c(CH3COO-)之比为1∶2。选D。
本题难度: 一般
5、选择题 下列各组离子一定能大量共存的是
A.常温下 的溶液:
的溶液: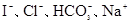
B.含有大量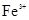 的溶液:
的溶液: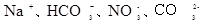

C.加入铝粉能产生氢气的溶液: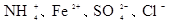
D.由水电离出的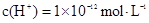 溶液:
溶液: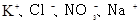
参考答案:D
本题解析:A错,常温下 的溶液为碱性溶液,在碱性溶液中
的溶液为碱性溶液,在碱性溶液中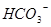 I不能共存;B错,
I不能共存;B错,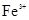 与碳酸根离子不能共存会发生双水解反应;C错,加入铝粉能产生氢气的溶液可以是酸溶液,也可以是碱溶液,铵离子、亚铁离子在碱溶液中不能共存;D正确;
与碳酸根离子不能共存会发生双水解反应;C错,加入铝粉能产生氢气的溶液可以是酸溶液,也可以是碱溶液,铵离子、亚铁离子在碱溶液中不能共存;D正确;
本题难度:一般