1、选择题 下列有关电解质溶液的叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
参考答案:D
本题解析:A、由题意知,酸和碱的物质的量相等,但酸和碱的元数未知,氢离子和氢氧根离子的物质的量大小不能确定,混合后溶液的酸碱性无法确定,错误;B、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(SO42-)增大,BaSO4的沉淀溶解平衡逆向移动,c(Ba2+)减小,错误;C、含l?mol?KOH的溶液与l?mol?CO2完全反应,生成碳酸氢钾,溶液中根据物料守恒得c(K+)=c(HCO3-)+c(CO32-)+c(H2CO3),错误;D、在CH3COONa溶液中加入适量CH3COOH,当溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知,溶液中c(Na+)=c(CH3COO-),正确。
本题难度:一般
2、选择题 下列各组离子在给定条件下一定能够大量共存的是(?)
A.使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+
B.c(H+)=1.0×10-13 mol/L 的溶液中:Na+、SO42-、Al O2-、CO32-
C.加入铝粉后能产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
D.由水电离出c(H+)=10-12 mol·L-1的溶液:K+、Al3+、Cl-、SO42-
参考答案:B
本题解析:略
本题难度:简单
3、选择题 能在溶液中大量共存的离子组是?(?)
A. 、
、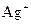 、
、 、
、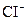
B. 、
、 、
、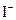 、
、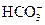
C.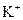 、
、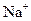 、
、 、
、
D. 、
、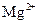 、
、 、
、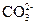
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Vb<10Va
参考答案:C
本题解析:溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,说明水的电离被抑制了,由于酸或碱均可以抑制,即该溶液可能显酸性也可能显碱性,AlO2-在酸性溶液中不能大量共存,A不正确。0.1mol/L HA溶液的pH>1,说明HA是弱酸,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,可以利用水的离子积常数计算出c(OH-)=0.1mol/L,所以碱是强碱,反应后溶液生成的盐AB水解显碱性,由于水解程度一般都比较小,所以离子浓度的大小顺序为c(B+)>c(A-)>c(OH-)>c(H+),B不正确。SO2具有还原性,溶于水显酸性,NO3-可以氧化二氧化硫生成硫酸钡沉淀,C正确。设pH=2和pH=3的醋酸的浓度分别是x和y,因为醋酸属于弱酸,若将pH=2的醋酸稀释10倍,溶液的pH应小于3,如果要稀释到pH=3,则需要继续加水,所以y<x/10,即x>10y,故Vb>10Va,D不正确。答案选C。
本题难度:简单
5、选择题 用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
A.Ca2+、K+、Cl-、SO32-
B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2-
D.Na+、S2O32-、AlO2—、K+
参考答案:B
本题解析:略
本题难度:一般