1、简答题 (1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上______(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为______,正极的电极反应式为______.
(2)如果烧杯中最初装入的是500mL2mol?L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)______.
参考答案:(1)铜片插入稀硫酸中时,二者不反应,没有气泡产生,但当把铜片和锌片用导线相连插入稀硫酸中时,会构成原电池,铜作为原电池正极,电极反应为2H++2e-═H2↑,锌作为原电池负极,电极反应为Zn-2e-═Zn2+,电池总反应为Zn+2H+═Zn2++H2↑,故答案为:没有;锌片;2H++2e-═H2↑;
(2)当收集到11.2LH2(标准状况),即0.5molH2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,
c(H2SO4)=0.5L×2mol?L-1-0.5mol0.5L=1mol?L-1,c(ZnSO4)=0.5mol0.5L=1mol?L-1.
故答案为:c(H2SO4)=1mol?L-1,c(ZnSO4)=1mol?L-1.
本题解析:
本题难度:简单
2、计算题 按下图装置进行实验,并回答下列问题
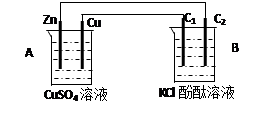
(1)判断装置的名称:B池为
(2)铜极为______极,电极反应式为
石墨棒C2附近发生的实验现象为
(3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少) g.
CuSO4溶液的质量变化了(增加或减少了) g .
参考答案:(共9分,前3空每空1分,其余各2分)
(1) 电解池 (2)正 Cu2+ + 2e- = Cu 有气泡冒出,溶液变红
(3)减少 0.65 增加 0.01
本题解析:(1)锌能和硫酸铜发生置换反应,所以根据装置结构特点可知,A是原电池,则B就是电解池。
(2)铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2+ + 2e- = Cu。石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以附近发生的实验现象为有气泡冒出,溶液变红。
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。
考点:考查原电池和电解池的有关判断和计算
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中。主要是考查学生对电化学原理的了解掌握程度,有助于培养学生的逻辑思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 以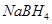 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是

A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:
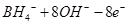 =
=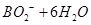
D.电路中通过6.02×1022个电子时,理论上消耗 mol
mol
参考答案:D
本题解析:B、H2O2具有强氧化性,易得电子,所以电极b为原电池的正极,正确;A、电池内部阳离子向正极移动,所以该电池工作时Na+由a极区移向b极区,正确;C、BH4-在负极上失去电子,生成BO2-,配平可得电极方程式:BH4-+8OH?—8e?= BO2-+6H2O,正确;D、根据化合价的变化可得H2O2与转移电子的对应关系:H2O2 ~2e?,所以电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol。
本题难度:简单
4、选择题 熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是(? )
A.通CO的一极是电池的正极
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式为:O2+2CO2+4e-→2CO32-
D.正极反应式为:2CO+2CO32-→4CO2+4e-
参考答案:B
本题解析:由题意可知通入CO的一极为负极、失电子,且电极反应式为2CO+2CO32--4e-=4CO2;正极反应式为O2+2CO2+4e-=2CO32-,所以确定A、C、D错误;B项正确。
本题难度:一般
5、选择题 锌铜原电池产生电流时,阴离子
A.移向Zn极,阳离子移向Cu极
B.移向Cu极,阳离子移向Zn极
C.和阳离子都移向Zn极
D.和阳离子都移向Cu极
参考答案:A
本题解析:
本题难度:困难