|
|
|
高考化学必考知识点《水的电离平衡》练习题(六)
2019-05-30 04:05:02
【 大 中 小】
|
1、选择题 25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
参考答案:A.水的电离是吸热过程,升高温度,平衡向电离方向移动,Kw增大,c(H+)增大,则pH减小,故A错误;
B.向水中加入少量固体硫酸氢钠,硫酸氢钠在水溶液中电离出钠离子、氢离子和硫酸根离子,导致c(H+)增大,平衡逆向移动,Kw只受温度的影响,温度不变,Kw不变,故B正确;
C.向水中加入少量固体NaOH,c(OH-)增大,平衡逆向移动,c(H+)降低,c(OH-)增大,故C错误;
D.向水中加入少量固体NH4Cl,铵根离子会和氢氧根离子之间反应,c(OH-)减小,导致平衡正向移动,c(H+)增大,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 常温下,用 0.1000 mol·L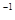 NaOH溶液滴定 20.00mL0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L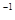 CH3COOH溶液所得滴定曲线如图。下列说法正确的是 CH3COOH溶液所得滴定曲线如图。下列说法正确的是
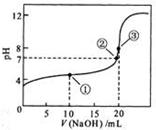
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
| c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
参考答案:D
本题解析:A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A错;
B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故B错;
C、点③说明两溶液恰好完全反应生成CH3COONa,由于CH3COO-水解,且程度较小,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错;
D、当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确,答案选D。
考点:考查NaOH与CH3COOH的反应中离子浓度比较以及滴定曲线的识别
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,注重答题的灵活性。该题难度较大,对学生的思维能力提出了较高的要求,涉及盐类的水解和溶液离子浓度的大小比较,注意利用电荷守恒的角度解答。
本题难度:困难
3、填空题 下列物质中,属于电解质的是______(填序号),写出任意电解质在水溶液中的电离方程式______
A.氯化钠溶液?B.硫酸?C.醋酸?D.氯化银?E.酒精?F.蔗糖?G.氨气
H.三氧化硫?I.铜?J.硫酸钡.
参考答案:电解质在熔融状态或水溶液中能导电的化合物,包括酸、碱、盐、氧化物等化合物;
氯化钠溶液为混合物,不属于电解质;
酒精、蔗糖属于非电解质;
氨气、三氧化硫的水溶液能导电,但本身不能电离出离子,属于非电解质;
铜为单质,既不是电解质,也不是非电解质,
属于电解质的为B、C、D、J,
硫酸为电解质,在水溶液中电离生成H+和SO42-,电离方程式为H2SO4=2H++SO42-,故答案为:H2SO4=2H++SO42-.
本题解析:
本题难度:简单
4、实验题 (9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。
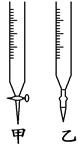
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。
B.酸式滴定管滴定前有气泡,滴定后气泡消失。
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。
D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。
|
参考答案:(9分)(1)用标准盐酸溶液润洗(2分) ;(2) 甲(1分);
(3)锥形瓶中溶液的颜色变化(2分)
(4)由黄(1分)色变为橙色(1分) ;(4)AB(2分)。
本题解析:(1)酸式滴定管用蒸馏水洗净后,为了洗去蒸馏水,应用标准盐酸溶液润洗2-3次;(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入酸式滴定管中;(3)滴定时,眼睛注视锥形瓶中溶液的颜色变化,当溶液由黄色变为橙色达到滴定终点;(4)甲基橙在碱性条件下呈黄色,在酸性条件下呈红色,中性色为橙色,变色范围pH为3.1-4.4;(5)A、酸式滴定管未用标准盐酸润洗,直接装入标准盐酸,标准盐酸被稀释,所用体积偏大,所测氢氧化钠浓度偏高;B、酸式滴定管滴定前有气泡,滴定后气泡消失,所读标准酸溶液的体积偏大,所测结果偏高;C、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥,不影响滴定结果;D、读取盐酸体积开始时仰视读数,滴定结束后俯视读数,所读标准盐酸体积偏小,测定结果偏低;答案选AB。
考点:酸碱中和滴定
本题难度:一般
5、选择题 下列操作中,能使电离平衡H2O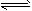 H++OH-,向右移动且溶液呈酸性的是
H++OH-,向右移动且溶液呈酸性的是
[? ]
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
参考答案:B
本题解析:
本题难度:一般
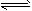 H++OH-,向右移动且溶液呈酸性的是
H++OH-,向右移动且溶液呈酸性的是